autres séries
\
Les valeurs pour \(n_2\) et wavenumber \(\widetilde{\nu}\) pour vous savez dans quelle région du rayonnement électromagnétique se trouvent ces lignes? Bien sûr, ces lignes sont dans la région UV, et elles ne sont pas visibles, mais elles sont détectées par des instruments; ces lignes forment une série de Lyman., Les existences de la série Lyman et de la série Balmer suggèrent l’existence d’autres séries. Par exemple, la série avec \(n_2 = 3\) et \(n_1\) = 4, 5, 6, 7, … s’appelle la série Pashen.
Plusieurs séries
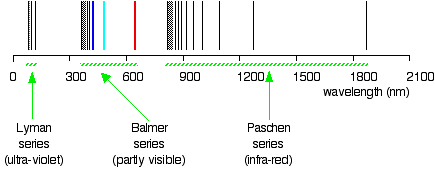
exemple \(\PageIndex{1}\): La série Lyman
la série dite Lyman de raies dans le spectre d’émission de l’hydrogène correspond à des transitions de divers états excités à l’orbite n = 1. Calculez la longueur d’onde de la ligne de la plus basse énergie de la série Lyman à trois chiffres significatifs. Dans quelle région du spectre électromagnétique se produit-il?,
étant donné: orbite de la plus basse énergie de la série Lyman
demandé: longueur d’onde de la ligne Lyman de la plus basse énergie et région correspondante du spectre
stratégie:
Solution:
Nous pouvons utiliser L’équation de Rydberg (équation \ref{1.5.1}) Pour calculer la longueur d’onde:
\
a pour la série Lyman, \(n_1 = 1\).
Les Spectroscopistes parlent souvent d’énergie et de fréquence comme équivalentes. L’Unité cm-1 (wavenumbers) est particulièrement pratique. Nous pouvons convertir la réponse de la partie A en cm-1.,
et
\
Cette ligne d’émission est appelée Lyman alpha et est la ligne d’émission atomique la plus forte du soleil et entraîne la chimie de la haute atmosphère de toutes les planètes produisant des ions en dépouillant les électrons des atomes et des molécules. Il est complètement absorbé par l’oxygène dans la stratosphère supérieure, dissociant les molécules D’O2 en atomes D’o qui réagissent avec d’autres molécules D’O2 pour former de l’ozone stratosphérique
B Cette longueur d’onde est dans la région ultraviolette du spectre.,
exercice \(\PageIndex{1}\): La série de Pfund
la série de Pfund de raies dans le spectre d’émission de l’hydrogène correspond à des transitions d’états excités supérieurs à la \(n_1 = 5\). Calculez la longueur d’onde de la deuxième ligne de la série de Pfund à trois chiffres significatifs. Dans quelle région du spectre se trouve-t-il?
réponse
\(4,65 \fois 10^3\, nm\); infrarouge
la discussion ci-dessus ne présente qu’une description phénoménologique des raies d’émission d’hydrogène et ne fournit pas de sonde de la nature de l’atome lui-même., Il est clair qu’un modèle de continuum basé sur la mécanique classique n’est pas applicable, et comme le montre la Section suivante, une connexion simple entre les spectres et la structure atomique peut être formulée.
