6.3 Comment l’énergie est liée à la longueur d’onde du rayonnement?
Nous pouvons considérer le rayonnement soit comme des ondes, soit comme des particules individuelles appelées photons. L’énergie associée à un photon unique est donnée par E = hv , où E est l’énergie (unités SI de J), h est la constante de Planck (h = 6,626 x 10-34 J s) et ν est la fréquence du rayonnement (unités SI de s–1 ou Hertz, Hz) (voir figure ci-dessous)., La fréquence est liée à la longueur d’onde Par λ=c/ν , Où c, la vitesse de la lumière, est 2,998 x 108 m s–1. Une autre quantité que vous verrez souvent est wavenumber, σ=1/λ, Qui est généralement rapporté en unités de cm–1.
L’énergie d’un photon unique qui a la longueur d’onde λ est donnée par:
E = hc λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., L’énergie d’une mole de photons qui ont la longueur d’onde λ est obtenu en multipliant l’équation ci-dessus par le nombre d’Avogadro:
E m = hc N λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
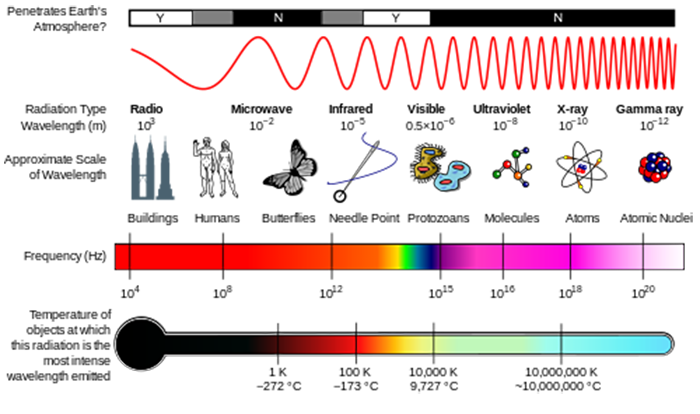
dans la leçon sur la composition atmosphérique, vous avez vu comment le rayonnement UV solaire était capable de briser les molécules pour initier la chimie atmosphérique. Ces molécules absorbent l’énergie d’un photon de rayonnement, et si cette énergie de photon est supérieure à la force de la liaison chimique, la molécule peut se séparer.
Vérifiez votre compréhension
considérez la réaction O3 + UV → O2 + O*. Si la force de liaison entre O2 et O* (c.-à-d.,, état excité atome d’oxygène) est de 386 kJ mol–1, Quelle est la plus longue longueur d’onde qu’un photon peut avoir et encore briser cette liaison?
réponse: résoudre pour la longueur d’onde dans l’équation
λ= 1.196 × 10 8 J nm mol -1 E m = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
