Introduction
Les infections nosocomiales causées par Acinetobacter baumannii multirésistant aux médicaments deviennent de plus en plus courantes dans le monde entier, en particulier dans le cadre des soins intensifs (Wieland et al., 2018). Le succès de cette bactérie est facilité par sa capacité à survivre dans une variété d’environnements aggravée par sa capacité rapide à acquérir une multirésistance aux médicaments. Les glucides de Surface jouent un rôle clé dans la forme physique globale et la virulence de A., baumannii (Lees-Miller et coll., 2013; Geisinger et Isberg, 2015; Weber et coll., 2016). A. baumannii produit un polysaccharide capsulaire de haut poids moléculaire (CPS) qui entoure la membrane externe (Figure 1) (Russo et al., 2010). Composé de sous-unités oligosaccharidiques répétitives (unités K) étroitement emballées, le CPS forme une couche discrète sur la surface bactérienne offrant une protection contre diverses conditions environnementales, aidant à l’évasion des défenses immunitaires de l’hôte et augmentant la résistance à un certain nombre de composés antimicrobiens (Russo et al., 2010; Iwashkiw et coll., 2012; Geisinger et Isberg, 2015).,
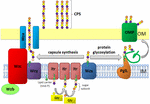
la Figure 1. Représentation schématique de l’assemblage et de l’exportation de polysaccharides de capsules chez A. baumannii. La synthèse commence par la transférase initiale (Itr; marron) située dans la membrane interne (IM) transférant le premier sucre de l’unité répétitive à un transporteur lipidique (Und-P; cercle vert). Les sucres suivants sont ensuite ajoutés à l’Unité de croissance par des glycosyltransférases spécifiques (Gtr; jaune) du côté cytosolique de la membrane interne., La sous-unité de la capsule (unité K) est ensuite transférée au périplasme via la protéine membranaire intégrale Wzx (bleu foncé). Les sous-unités de sucre sont polymérisées par la protéine WZY (violet) et le complexe Wza/Wzb/WZC (cyan, chaux, rouge) coordonne la polymérisation de haut niveau et l’exportation de la chaîne de croissance, les déplaçant vers la membrane externe (OM). Pour la glycosylation, PglL (orange) relie les unités K sur des protéines de membrane externe sélectionnées (OMP; vert foncé).
chez A. baumannii, l’assemblage et l’exportation des capsules se font par une voie dépendant de Wzy (Hu et al.,, 2013; Kenyon, et la Salle, 2013; Willis et Whitfield, 2013; Woodward et Naismith, 2016) (Figure 1). Généralement constituée de 4 à 6 sucres, L’unité K est assemblée sur la molécule porteuse de lipides undécaprenyl pyrophosphate (Und-P) qui fournit un échafaudage pour la chaîne de sucre en croissance (Whitfield, 2006). Le premier sucre de L’unité K est recruté par une transférase initiale liée à la membrane interne (IM) (Itr), suivie de l’addition séquentielle de sucres à l’unité K en croissance par des enzymes spécifiques de la glycosyl transférase (Gtr) (Figure 1) (Woodward et Naismith, 2016)., Chaque unité K est ensuite transférée vers le côté périplasmique de L’IM par la translocase Wzx et polymérisée par Wzy, qui transfère la chaîne polysaccharidique en croissance d’un transporteur Und-P à la sous-unité entrante suivante (Figure 1) (Collins et al., 2007). Une fois le polymère CPS synthétisé, il est transporté à la surface cellulaire par un processus hautement coordonné impliquant l’interaction de trois protéines; Wza, Wzb et Wzc, qui composent la machinerie d’exportation (Figure 1)., La synthèse CPS représente un bras d’une voie bifurquée, car ces unités K sont également utilisées pour décorer certaines protéines de surface via la glycosylation des protéines o-liées (Lees-Miller et al., 2013). Dans ce cas, des unités K simples sont transférées aux protéines receveuses par L’o-oligosaccharyltransférase PglL (Figure 1) (Iwashkiw et al., 2012). Chez A. baumannii, la glycosylation des protéines contribue à la formation de biofilms en améliorant la fixation initiale et la maturation des biofilms, ainsi que la pathogénicité démontrée dans un certain nombre de modèles d’infection animale (Iwashkiw et al., 2012; Scott et coll., 2014; Harding et coll.,, 2015). Le Biofilm est un État de croissance dans lequel les communautés bactériennes sont enfermées dans une matrice d’exopolysaccharides et il a été démontré qu’il joue un rôle important dans la persistance et la résistance d’A. baumannii.
d’autres hydrates de carbone de surface connus pour influencer la pathogénicité d’A. baumannii comprennent le lipoligosaccharide (LOS) et l’exopolysaccharide poly-β-(1-6)-N-acétylglucosamine (PNAG) (Preston et al., 1996; Weber et coll., 2016). PNAG forme la « colle » cohésive des biofilms et constitue une proportion substantielle des biofilms (Choi et al., 2009; Longo et coll., 2014)., Contrairement à la plupart des bactéries à Gram négatif, A. baumannii ne produit pas de lipopolysaccharide traditionnel, mais plutôt un glyco-conjugué de surface similaire, LOS, composé d’un noyau lipidique A dépourvu D’antigène O (Kenyon et Hall, 2013; Kenyon et al., 2014b). La perte de production de LOS chez A. baumannii diminue la stabilité de la membrane externe, ce qui entraîne une remise en forme réduite (Moffatt et al., 2010; Beceiro et coll., 2014).
bien que de nombreuses fractions de glucides influencent la pathogénicité, on peut soutenir que le CPS est un facteur de virulence prédominant chez A. baumannii. Cette revue vise à consolider ce que L’on sait sur A., la capsule baumannii comprend des structures sélectionnées, la biosynthèse et l’organisation des gènes, le rôle du CPS dans la virulence et le potentiel du CPS en tant que cible pour le développement futur de vaccins et de médicaments.
organisation génétique des Loci K
Au fur et à mesure que les génomes complets d’un plus grand nombre d’isolats D’A. baumannii deviennent disponibles, la véritable diversité des structures de capsules présentes dans cette bactérie devient évidente. À ce jour, plus de 100 locus de capsule uniques (KL) ont été identifiés chez A. baumannii (Figure 2A) (Shashkov et al., 2017). Ces régions varient généralement de 20 à 35 Ko., L’analyse des gènes dirigeant la synthèse de CPS dans dix génomes complets D’A. baumannii a initialement abouti à la désignation de neuf types de capsules, KL1–KL9, qui sont devenus la base d’un schéma de typage universel pour ces locus (Kenyon et Hall, 2013). Ce système a par la suite été élargi pour permettre l’identification de nouveaux loci K. L’emplacement chromosomique du locus K, entre les gènes fkpA et lldP, est hautement conservé entre les souches D’A. baumannii et contient les gènes nécessaires à la biosynthèse et à l’exportation spécifiques à chaque type de CPS (Figure 2) (Hu et al.,, 2013; Kenyon, et la Salle, 2013). Une exception à cette règle sont les souches d’A. baumannii possédant les régions KL19 et KL39, où le gène codant la polymérase Wzy, wzy, se trouve sur une petite île génétique ailleurs sur le chromosome (Kenyon et al., 2016a). De plus, les gènes requis pour certains des sucres courants observés dans le CPS se trouvent ailleurs., Tous les loci K présentent une configuration génétique similaire, un groupe très variable de gènes de synthèse et de transférase requis pour la biosynthèse de sucres complexes uniques de type KL, flanqué d’un côté par les gènes D’exportation CPS hautement conservés, et de l’autre côté par un ensemble de gènes codant pour les sucres simples conservés et les précurseurs (Figure 2A)., Les gènes WZX et wzy requis pour le traitement des unités répétées sont très variables entre les loci K (Figure 2a, bleu clair), indiquant la spécificité pour des structures D’unités K particulières et, en général, l’ordre des déterminants du RTM, codant des glycosyltransférases spécifiques dans les régions KL, correspond inversement à l’ordre d’action.
la région variable de certains groupes de gènes KL, tels que KL37 et KL14, manque de gènes pour la synthèse complexe du sucre, car ils ne contiennent que des sucres simples dans leurs unités K (Arbatsky et al., 2015; Kenyon et coll.,, 2015). En plus de leur diversité, plusieurs régions KL contiennent des gènes redondants qui ne sont pas nécessaires à la synthèse de l’unité K finale. Par exemple, KL8 et KL9 contiennent deux gènes itr (Kenyon et Hall, 2013) et KL37 a la phosphoglycéroltransférase pgt1, mais aucun résidu phosphoglycérol correspondant dans la structure déterminée (Arbatsky et al., 2015). De plus, dans KL93, deux éléments de séquence d’insertion (ISAba26 et ISAba22) interrompent le déterminant pgt1 (Figure 2) (Kasimova et al., 2017)., Les gènes requis pour la biosynthèse spécifique du sucre ne seront pas discutés car ces voies ont été couvertes précédemment et dépassent la portée de cette revue (Hu et al., 2013; Kenyon, et la Salle, 2013). De plus, d’autres gènes situés à L’intérieur du KL codent des produits censés être impliqués dans l’acétylation ou la modification par acylation de glycanes spécifiques (Figure 2a, rose). Bien que l’examen des locus K puisse révéler beaucoup de choses sur les structures des unités K, une analyse chimique et des tests biochimiques sont nécessaires pour déterminer les structures exactes et identifier les liens spécifiques entre les sucres répétés.,
Structures du CPS
Les premières études sur le sérotypage du CPS chez A. baumannii ont été motivées par la nécessité de mettre au point une méthode pour distinguer les isolats D’A. baumannii des autres espèces D’Acinetobacter, car l’analyse phénotypique était chargée d’ambiguïté et d’identification erronée (Traub, 1989). Comme décrit ci-dessus, il existe une diversité phénoménale observée dans les clusters de gènes de biosynthèse de A. baumannii CPS, ce qui se traduit par la diversité observée dans la structure de L’unité K (Hu et al., 2013; Kenyon, et la Salle, 2013). Collectivement, plus de 40 Divers A., les structures des unités K de baumannii ont été élucidées jusqu’à présent à l’aide de la spectroscopie RMN et de l’analyse chimique. Les structures de l’unité K diffèrent par la composition du sucre. Ils peuvent comprendre des dérivés de sucres communs liés à L’UDP tels que le glucose, le galactose et l’acide glucuronique ou des sucres rares et atypiques tels que les acides non-2-ulosoniques. Les Structures varient en longueur et peuvent être constituées de seulement deux résidus, comme on l’a vu pour les CPS de type K53 (Shashkov et al., 2018), ou jusqu’à cinq ou six monosaccharides, comme celui observé dans K37 (Figure 2b) (Arbatsky et al., 2015)., Les Structures diffèrent également dans les liens à L’intérieur et entre les unités K, ce qui entraîne la production D’unités K linéaires ou impliquant des branches latérales, comme on le voit dans K1 et K93, respectivement (Figure 2b) (Kenyon et al., 2016a; Kasimova et coll., 2017). Les différences dans l’emplacement des liaisons glycosidiques spécifiques et les schémas D’o-acétylation de divers oligosaccharides au sein d’une structure contribuent également à la diversité des unités K.,
la Variation entre les structures de L’unité K peut être subtile, par exemple, K12 et K13 ne diffèrent que par la liaison de deux glycanes, ce qui nécessite l’utilisation d’une polymérase WZY alternative; en conséquence, les loci K des deux souches sont identiques sauf pour le gène wzy (Figure 2). Alternativement, la variation peut être frappante, telle que l’incorporation de sucres rares comprenant des dérivés d’acide pseudaminique, légionaminique ou acinétaminique, comme on le voit dans les structures K2/6, K49 et K12/13, respectivement (Figure 2) (Kenyon et al., 2014a, 2015; Vinogradov et coll., 2014; Kasimova et coll., 2018)., Fait intéressant, les dérivés de l’acide acinétaminique n’ont été identifiés que chez A. baumannii et ne se trouvent nulle part ailleurs dans la nature (Kenyon et al., 2017). De plus, certaines unités K incorporent des dérivés uniques de glycanes spécifiques, par exemple l’acide pseudaminique de K93 est acétylé avec un groupe (R)-3-hydroxybutanoyl (Kasimova et al., 2017), alors que dans K2 et K6, l’acide pseudaminique est non acétylé (Figure 2)., De plus, la structure de K4 est unique car elle ne contient que des aminosugars, du D-QuipNAc et une branche terminale de N-acétyl-D-galactosamine (d-GalpNAcA) qui est coiffée d’un groupe pyruvyle, motif rare et le premier à être décrit chez Acinetobacter (Figure 2a, noir) (Kenyon et al., 2016b). Au fur et à mesure que le nombre de structures d’unités K élucidées augmente, la confiance pour déduire la structure d’unités K à partir de l’analyse des amas de biosynthèse positionnés dans le KL D’A. baumannii augmente., Cependant, bien qu’informatif, une compréhension du rôle de la CPS dans la pathogenèse est importante pour appliquer ces connaissances à l’amélioration des résultats des infections à A. baumannii.
rôle dans la Virulence, la Résistance aux antimicrobiens et la persistance
il ne fait aucun doute que la présence de CPS est essentielle à la pathogénicité d’A. baumannii. Il est nécessaire non seulement pour l’évasion des défenses immunitaires (Russo et coll., 2010; Geisinger et Isberg, 2015), mais il est important pour la résistance aux composés antimicrobiens et la survie dans des environnements défavorables (Luke et al., 2010; Russo et coll.,, 2010; Geisinger et Isberg, 2015). CPS Médie l’évasion immunitaire chez de nombreuses souches D’A. baumannii en limitant les interactions entre les structures de surface immunogènes de la bactérie et les défenses de l’hôte (Preston et al., 1996; Wu et coll., 2009; Russo et coll., 2010; Umland et coll., 2012; Lees-Miller et coll., 2013; Geisinger et Isberg, 2015; Wang-Lin et coll., 2017). L’abolition de la capsule dans plusieurs souches différentes D’A. baumannii a montré une survie réduite dans le sérum humain et le liquide ascite, et une atténuation dans les modèles d’infection chez le rat et le Murin (Russo et al., 2010; Umland et coll., 2012; Lees-Miller et coll.,, 2013; Sanchez-Larrayoz et coll., 2017). En outre, la régulation ascendante de la production de capsules dans la souche ATCC 17978 (Type K3 CPS) couramment utilisée A. baumannii a augmenté la résistance sérique et la virulence dans un modèle d’infection murin (Geisinger et Isberg, 2015). De plus, de nouveaux traitements antimicrobiens pourraient être développés pour des types spécifiques de CPS, par exemple ceux contenant de l’acide pseudaminique, car sa présence a été corrélée à une virulence accrue (Hitchen et al., 2010; Kao et coll., 2016).
outre la protection contre les défenses de l’hôte, dans A., la production de baumannii CPS augmente la résistance à une gamme de composés antimicrobiens, y compris ceux utilisés pour la désinfection en milieu clinique (Geisinger et Isberg, 2015; Tipton et al., 2015; Chen et coll., 2017). De plus, la croissance d’A. baumannii à des niveaux sous-inhibiteurs d’antimicrobiens influence la production de CPS. Par exemple, l’exposition aux antibiotiques chloramphénicol ou érythromycine a conduit à une synthèse améliorée de la capsule dans ATCC 17978 (Geisinger et Isberg ,2015) et à une exposition au méropénème sélectionnée pour des mutations entraînant une perte de production de CPS dans l’isolat 37662 (Chen et al., 2017)., Des études menées sur un plus large éventail de souches D’A. baumannii sont nécessaires pour déterminer si la protection contre les antimicrobiens offerte par le CPS est spécifique à la souche, spécifique au type de capsule ou universelle.
la capacité d’A. baumannii à persister dans l’environnement clinique a sans aucun doute amélioré la colonisation et les infections chez les patients sensibles. A. baumannii est capable de survivre pendant des mois sur des surfaces hospitalières telles que des rails de lit, des meubles et des dispositifs médicaux, fournissant un réservoir qui est souvent la source de transmission et d’infection (Wendt et al., 1997; Gayoso et coll., 2013)., On pense que la remarquable tolérance à la dessiccation de l’A. baumannii est due à une stratégie de « buste ou de boom » , où une sous-population persistante de cellules survit au détriment des cellules mourantes; CPS améliore la tolérance à la dessiccation en fournissant une barrière physique facilitant la rétention d’eau (Roberts, 1996; Webster et al., 2000; Gayoso et coll., 2013; Bravo et coll., 2016). Un rôle direct du CPS dans la résistance à la dessiccation a été récemment démontré chez la souche AB5075 (Type K25 CPS) D’A. baumannii. Dans cette étude, la variante acapsulaire D’AB5075 a affiché un 2.,Réduction de 5 fois de la viabilité par rapport à la souche parentale (Tipton et al., 2018). De plus, chez deux proches parents d’A. baumannii, Acinetobacter calcoaceticus et Acinetobacter baylyi, la production d’exopolysaccharide et/ou de CPS favorise la survie par dessiccation (Roberson et Firestone, 1992; Ophir et Gutnick, 1994). En plus d’influencer la résistance à la dessiccation, le CPS a été associé à d’autres traits de virulence, y compris la motilité (McQueary et al., 2012; Huang et coll., 2014) et la production de biofilm (Umland et al., 2012; Lees-Miller et coll.,, 2013), cimentant ainsi son rôle de facteur pathogène.
des études récentes ont établi un lien entre le phénotype variable de phase D’A. baumannii AB5075 et des altérations de la production de CPS, car des variants opaques très virulents produisent une couche de CPS deux fois plus épaisse que leurs homologues translucides (Chin et al., 2018). Cette transition de translucide à opaque a également considérablement augmenté le potentiel pathogène de A. baumannii AB5075. La résistance aux désinfectants hospitaliers courants et à un sous-ensemble d’antibiotiques aminoglycosides a également augmenté (Tipton et al., 2015; Chin et coll.,, 2018) et les variantes opaques étaient également plus résistantes au lysozyme humain, au peptide antimicrobien LL37 lié à la cathélicidine et au peroxyde d’hydrogène que les colonies translucides (Chin et al., 2018). De plus, les isolats opaques avaient une tolérance accrue aux conditions desséchées et leurs homologues translucides étaient plus compétitifs dans un modèle d’infection de souris (Chin et al., 2018). Comme plusieurs facteurs sont impliqués dans la variation de phase, d’autres études ont été effectuées pour déterminer la contribution de la production de CPS au phénotype opaque plus virulent., Dans une publication suivante, Les auteurs ont démontré qu’une variante acapsulaire était significativement plus sensible au lysozyme et aux désinfectants que son parent opaque de type sauvage AB5075 (Tipton et al., 2018). Fait intéressant, il n’y avait pas de différence de résistance au LL-37 et au peroxyde d’hydrogène entre les souches opaques de type sauvage et acapsulaires, suggérant que des facteurs autres que la production de CPS conduisent à ce phénotype pour les variantes opaques d’A. baumannii (Tipton et al., 2018).,
régulation de la Production de CPS
des indices environnementaux, tels que la température, la pression osmotique et les changements dans la disponibilité des métabolites et des ions peuvent influencer la production bactérienne de CPS (Hagiwara et al., 2003; Lai et coll., 2003; Mouslim et coll., 2004; Willenborg et coll., 2011). Il n’est pas surprenant que peu de mécanismes de réglementation aient été identifiés pour la production de CPS, car les niveaux de CPS sont généralement réglementés après la traduction par la phosphorylation des machines d’exportation de CPS (Whitfield et Paiment, 2003; Chiang et al., 2017). En A., baumannii, seuls deux régulateurs de la production de capsules ont été identifiés à ce jour; BfmRS et OmpR-EnvZ, deux systèmes de transduction de signaux à deux composants qui jouent de multiples rôles régulateurs impliqués dans la biogenèse de l’enveloppe (Geisinger et Isberg, 2015; Tipton et Rather, 2017; Geisinger et al., 2018). Lorsqu’elle est soumise à une pression antibiotique, L’expression D’A. baumannii ATCC 17978 cps a été augmentée de manière BfmRS-dépendante (Geisinger et Isberg, 2015). La variation de Phase, et donc potentiellement la production de CPS, est fortement régulée par le système OmpR-EnvZ en A., baumannii AB5075, car des mutations dans OmpR ou EnvZ ont entraîné une augmentation significative de la fréquence de commutation opaque à translucide (Tipton and Rather, 2017). Bien que le passage de translucide à opaque entraîne une double augmentation de l’épaisseur de la capsule, les analyses transcriptomiques n’ont pas identifié de différences dans les niveaux d’expression des gènes KL entre les deux phases.
CPS comme cible pour le développement de vaccins et de traitements contre A. baumannii
antibiotique (en particulier le cabapénème) résistant A., les baumannii sont classés comme organisme critique de priorité 1 de l’Organisation Mondiale de la santé pour le développement de nouveaux antimicrobiens (OMS, 2017). Bien qu’il n’existe actuellement aucun traitement ou vaccin non antibiotique homologué pour A. baumannii, leur développement suscite un intérêt accru et les études préliminaires semblent prometteuses. L’exposition en Surface et la prévalence chez les souches pathogènes d’A. baumannii font du CPS une cible idéale pour les traitements antimicrobiens et les vaccins (Russo et al., 2013)., Ceux-ci incluent le développement de thérapies à base d’anticorps telles que les vaccins prophylactiques, l’immunisation passive et la thérapie par phage (García-Quintanilla et al., 2013).
Plusieurs études ont montré l’efficacité de l’immunisation passive chez la souris à l’aide d’un anticorps spécifique à la CPS, qui protège contre le défi bactérien avec 13 à 55% des isolats cliniques D’A. baumannii (Russo et al., 2013; Yang et coll., 2017; Lee et coll., 2018)., De plus, l’inoculation avec des vaccins conjugués incorporant des glycanes CPS attachés à un transporteur de protéines procure une meilleure protection immunitaire que les CPS purifiés contre une gamme variée de souches D’A. baumannii (Yang et al., 2017).
L’intérêt pour la thérapie par phage pour traiter les infections bactériennes a augmenté ces dernières années en réponse à la crise actuelle de résistance croissante aux antimicrobiens. La thérapie par Phage est attrayante en tant que voie de traitement potentielle pour les infections multirésistantes D’A. baumannii., Par exemple, un phage codant pour une DÉPOLYMÉRASE CPS a été trouvé pour dégrader le CPS d’environ 10%, quatre sur 38, a. baumannii multirésistant clinique testé (Hernandez-Morales et al., 2018). Bien que la gamme d’hôtes de ce phage soit limitée, il pourrait être incorporé dans le cadre d’un cocktail de phages pour maximiser l’efficacité ou cibler des épidémies spécifiques (Hernandez-Morales et al., 2018). Un phage qui clive sélectivement la liaison de A., baumannii CPS à une branche d’acide pseudaminique peut être utile pour la thérapie par phage, ou pour fabriquer efficacement des CPS purifiés pour le développement de vaccins et d’anticorps (Lee et al., 2018). Il a été récemment démontré que le Phage ciblant A. baumannii était stable lorsqu’il était imprégné dans des produits de soin des plaies brûlées dans une gamme de conditions, y compris en présence d’antimicrobiens (Merabishvili et al., 2017). Cependant, comme la majorité des études portant sur le CPS D’A. baumannii se limitent généralement à une souche particulière D’A. baumannii, on ne sait pas si ces résultats se traduisent par tous les A., les isolats de baumannii ou s’ils sont spécifiques à une souche ou à une capsule. Comprendre quels rôles jouent les capsules dans plusieurs souches est primordial pour identifier les types de CPS qui représentent les meilleures cibles pour les nouveaux vaccins, ou si le développement d’antimicrobiens ciblant la voie de biosynthèse des capsules est même réalisable.
remarques finales
bien que la capsule représente un trait de virulence important chez A. baumannii, il existe peu de données disponibles sur le rôle des différents types de CPS dans la cause de la maladie., Pour développer des vaccins et des thérapies efficaces ciblant le CPS, nous devons d’abord acquérir une compréhension globale des mécanismes de sa synthèse et de son expression, ainsi que des avantages que la capsule transmet à la bactérie hôte. Cette recherche doit être abordée dans le contexte de la variation extrême des sérotypes de CPS trouvés chez A. baumannii, afin de s’assurer que les interventions potentielles fonctionnent contre les souches produisant diverses structures de CPS., D’autres études sur les CPS sont nécessaires pour fournir une plate-forme pour le développement de mesures préventives et de traitements contre cet agent pathogène humain de plus en plus persistant et mortel.
contributions des auteurs
JS a écrit la première ébauche. MB a fourni des commentaires académiques et une révision critique de l’article. FA a produit des alignements de génome et a fourni une révision critique du manuscrit. Tous les auteurs ont approuvé la version finale.
Financement
ce travail a été soutenu par une subvention de la Flinders Medical Research Foundation au Manitoba. FA a été soutenu par AJ et IM Naylon et Playford Trust Ph. D., Bourse. JS a été soutenu par une bourse AJ et IM Naylon.
déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Traub, W. H. (1989). Acinetobacter baumannii sérotypage pour la délimitation des éclosions d’infection nosocomiale de l’infection croisée. J. Clin. Microbiol. 27, 2713–2716.
PubMed Abstract | Google Scholar
Whitfield, C., et Paiement, A. (2003)., Biosynthèse et d’assemblage de Groupe 1 polysaccharides capsulaires dans Escherichia coli et liées à des polysaccharides extracellulaires chez d’autres bactéries. Carbohydr. Rés. 338, 2491-2502. doi: 10.1016/j.carres.2003.08.010
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
QUI (2017). Liste des priorités mondiales des bactéries résistantes aux antibiotiques pour guider la recherche, la découverte et le développement de nouveaux antibiotiques. Genève: Organisation Mondiale De La Santé.
Google Scholar
