Introduction au groupe carbonyle
en chimie organique, le groupe carbonyle est un groupe fonctionnel où l’atome de carbone et l’atome d’oxygène sont reliés par une double liaison. Les composés contiennent un groupe carbonyle sont connus sous le nom de composés carbonyle. Groupe carbonyle se réfère à un monoxyde de carbone peut également attaché à un atome inorganique comme un ligand qui est appelé métal carbonyle, par exemple nickel carbonyle.,
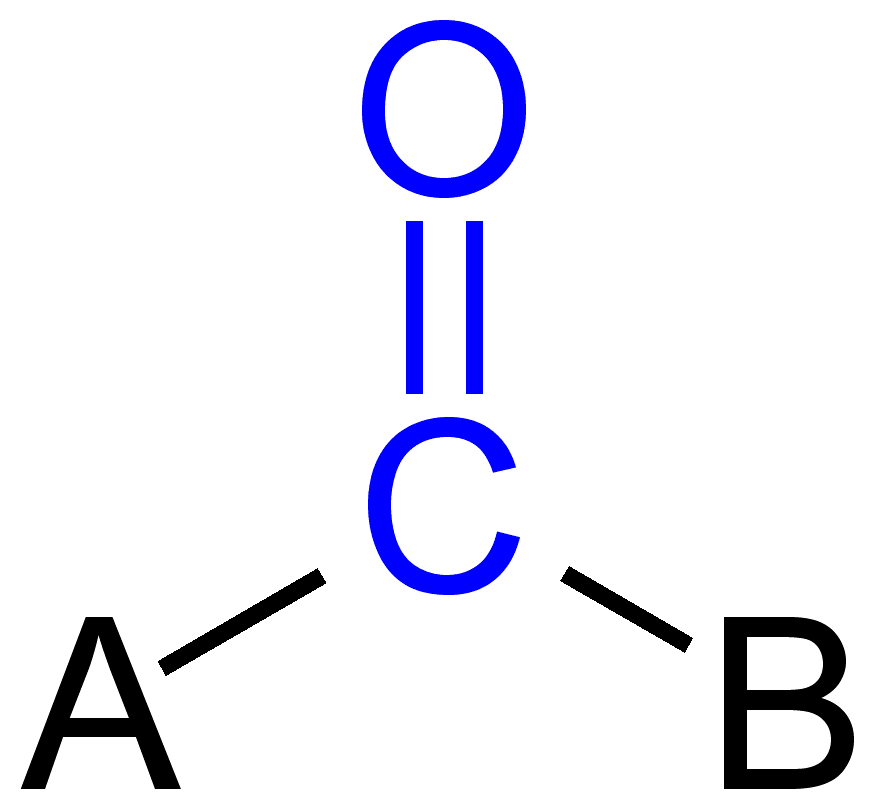
Certains groupes carbonyle
Double liaison dans le groupe carbonyle
Le carbone et l’atome d’oxygène dans le groupe carbonyle sont normalement hybridé sp2 et donc plannar. En raison de la présence d’oxygène en tant qu’atome électronégatif, la double liaison dans le groupe carbonyle est différente de la double liaison dans les alcènes en termes de réactivité. En raison de plus d’électronégativité et de la présence de deux paires d’électrons solitaires, l’oxygène devient une charge partiellement négative tandis que le carbone carbonyle génère une charge partiellement positive et donc une polarité est observée.,
structure de résonance carbonyle
en raison de la présence d’oxygène en tant qu’atome électronégatif, le groupe carbonyle présente une structure de résonance. La structure de résonance du groupe carbonyle affecte la réactivité du composé. L’atome d’oxygène plus électronégatif éloigne l’électron du centre du carbone, ce qui rend le carbone carbonyle partiellement électropositif et l’oxygène partiellement électronégatif. Ainsi, la polarité génère à l’intérieur du composé carbonyle.
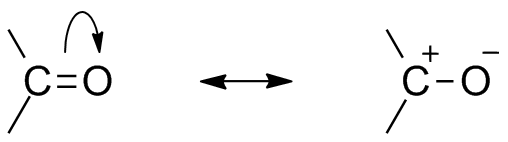
Ce électropositif carbone du carbonyle ou électrophile peut maintenant être attaqué par un nucléophile.,
réactivité
alkylation carbonyle
L’Alkylation du groupe carbonyle par réaction d’addition nucléophile utilisant le réactif de Grignard est représentée comme suit:

propriétés physiques des composés carbonyles
- Le point d’ébullition des aldéhydes et des cétones est point d’éthers et d’alcanes de masse moléculaire similaire.
- encore une fois, le point d’ébullition des aldéhydes et des cétones est inférieur à celui des alcools correspondants.,
- De nombreux aldéhydes supérieurs ont une odeur agréable et sont utilisés dans les parfums ou comme arôme artificiel alors que le membre inférieur de leur série homologue a une odeur âcre.
- les cétones supérieures ont une odeur fade et inférieures ont une odeur agréable, telle que l’acétone.
- Les petits aldéhydes et cétones sont solubles dans l’eau, mais à mesure que la longueur de la chaîne augmente, la solubilité diminue.
- Les forces de dispersion de van der Waals deviennent plus fortes à mesure que les molécules s’allongent.,
Liaison H dans le groupe carbonyle
en raison de la formation de Liaison H entre l’oxygène carbonyle et l’hydrogène de la molécule d’eau, les composés carbonyle inférieurs sont solubles dans l’eau. Mais à mesure que la chaîne augmente, elle forme une liaison hydrogène et la solubilité diminue.
attraction dipôle-dipôle de Van der Waals
en raison de la polarité dans le groupe carbonyle et de la présence de forces de dispersion, il y aura une attraction entre deux molécules voisines. Cela provoque le point d’ébullition des composés carbonylés aller plus haut que les alcanes., Dans le tableau suivant, notez que le point d’ébullition des composés carbonylés est supérieur aux alcanes correspondants et inférieur aux alcools.,v>Boiling point (o C)
Spectroscopy
Infrared spectroscopy
The absorption of carbonyl group depends on the geometry of the molecule., Habituellement, l’absorption de l’infra lumière montre à à wavenumbers environ 1600-1900 cm – 1 (5263 nm à 6250 nm).
Résonance Magnétique Nucléaire
la RMN du carbone carbonyle montre un pic approximativement entre 160-220 ppm.
