par Marilyn Haddrill
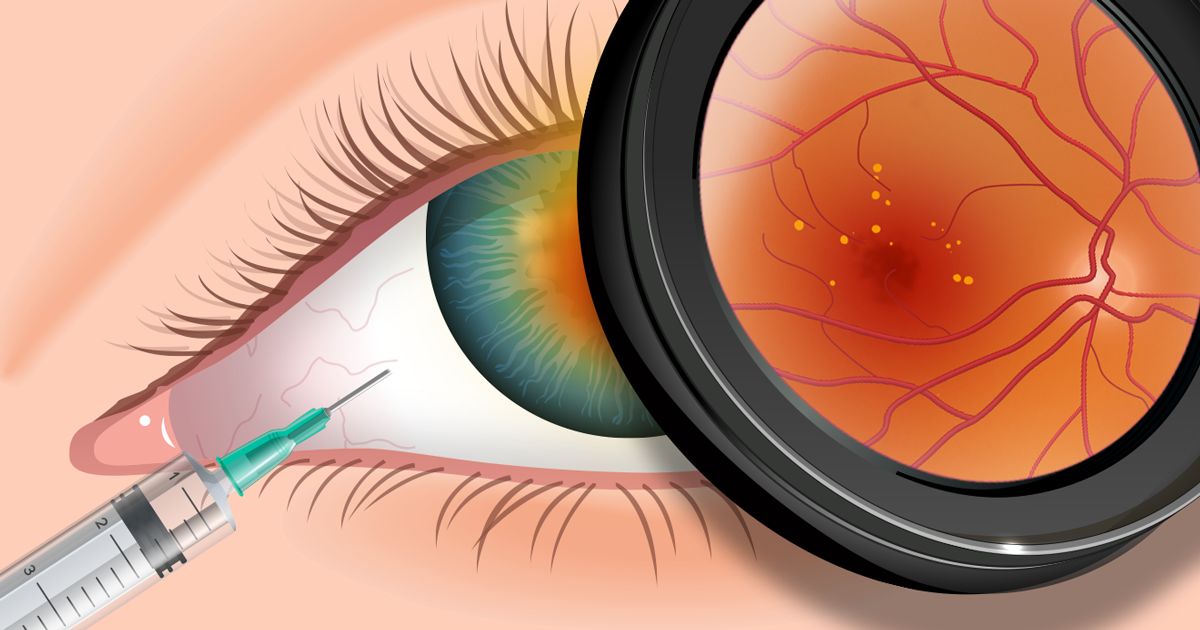
lorsque Lucentis (ranibizumab) a reçu l’approbation de la FDA à la fin de juin 2006, le nouveau médicament contre la dégénérescence maculaire a été
avec environ 200 000 nouveaux cas de dégénérescence maculaire avancée liée à l’âge (DMLA) identifiés chaque année aux États-Unis*, de nombreux Américains âgés atteints de formes plus sévères ou « humides » de DMLA ont subi une perte inévitable et progressive de la vision centrale.,
maintenant, il y a un nouvel espoir pour beaucoup de ceux qui ont déjà été confrontés à une certaine cécité. Lucentis dans les essais cliniques s’est avéré arrêter et, dans de nombreux cas, inverser au moins une certaine perte de vision chez la plupart des personnes atteintes de DMLA avancée. Ces résultats positifs font clairement Lucentis de loin le traitement approuvé PAR LA FDA le plus efficace actuellement disponible pour les formes plus dommageables de la DMLA.
mais certains ophtalmologistes soutiennent qu’un médicament étroitement lié au Lucentis, connu sous le nom D’Avastin (bevacizumab), s’est également révélé être une alternative très efficace et beaucoup moins chère pour les personnes à faible revenu atteintes de DMLA avancée., Le problème est que Avastin est approuvé PAR LA FDA uniquement pour le traitement du côlon et d’autres cancers, mais pas pour la dégénérescence maculaire. Comme alternative, de nombreux ophtalmologistes ont utilisé Avastin comme traitement hors étiquette.
Genentech limite les ventes D’Avastin pour les utilisations ophtalmiques
en octobre 2007, la société qui commercialise à la fois Lucentis et Avastin a annoncé une stratégie censée limiter la disponibilité d’Avastin pour les utilisations oculaires.,
la société, Genentech, a cité des problèmes de sécurité comme raison de l’arrêt des ventes D’Avastin aux pharmacies de composition qui ont divisé Avastin en plus petites quantités nécessaires pour traiter l’œil.
Genentech a plus tard répondu aux protestations généralisées des ophtalmologistes et des organisations, y compris L’American Academy of Ophthalmology (AAO) en annonçant que L’Avastin peut toujours être vendu directement aux médecins et livré aux destinations de leur choix — y compris les pharmacies de composition.,
lors d’une session de conférence chargée d’émotion de L’AAO en novembre 2007, les ophtalmologistes ont protesté contre la décision initiale qui, selon eux, aurait pu réduire considérablement l’approvisionnement en Avastin et priver les personnes à faible revenu d’un médicament permettant d’économiser la vue.
Les responsables de Genentech disent qu’ils n’interféreront pas avec le choix d’un médecin de prescrire Avastin pour des utilisations ophtalmiques. Mais alors que le médicament peut encore être vendu aux médecins, les ophtalmologistes disent que seules les pharmacies de composition peuvent traiter les problèmes de stérilité liés au reconditionnement D’Avastin pour injection dans l’œil.,
les ophtalmologistes à la conférence de L’AAO ont déclaré n’avoir vu aucune preuve que la FDA ait exprimé des préoccupations spécifiques concernant L’utilisation hors étiquette d’Avastin.
Joshua Wenderoff, porte-parole de L’Académie Internationale des pharmaciens de composition (IACP), a déclaré aux journalistes lors de la réunion de L’AAO qu’il contestait L’affirmation de Genentech selon laquelle la décision d’arrêter les ventes d’Avastin aux pharmacies de composition était basée sur des problèmes de sécurité.
« Nous pensons que Genentech fait passer le profit avant les patients », a déclaré Wenderoff.,
La Présidente du développement de produits de Genentech, Susan Desmond-Hellmann, MD, a défendu la position de son entreprise, affirmant qu’un inspecteur de la FDA avait posé de nombreuses questions sur le bien-fondé de la vente directe D’Avastin par Genentech aux pharmacies de composition et son utilisation hors étiquette comme médicament ophtalmique.
« Nous soutenons la décision que nous avons prise », a déclaré Desmond-Hellman.
Les responsables de Genentech disent travailler en étroite collaboration avec toutes les personnes qui pourraient faire face à des difficultés économiques liées à L’utilisation de Lucentis, y compris en fournissant des références à des organisations caritatives ou à d’autres organismes offrant de l’aide., Les Questions concernant l’aide économique recevront une réponse à ce numéro sans frais: 1-866-724-9394.
« notre raison d’être n’est pas financière », a déclaré Krysta D. Pellegrino, responsable des communications produits chez Genentech. « Nous ne croyons pas que cette décision augmentera les ventes de Lucentis. Nous nous attendons à ce que les médecins aient toujours accès à Avastin., »
suite à la réunion de L’AAO, Genentech a coopéré au compromis qui permet la vente d’Avastin directement aux médecins ophtalmologistes qui peuvent spécifier la livraison aux pharmacies de composition pour la formulation appropriée nécessaire au traitement de la dégénérescence maculaire liée à l’âge.
L’Avastin agit-il aussi bien que le Lucentis dans le traitement de la dégénérescence maculaire?
outre les problèmes de coût, un autre sujet de préoccupation concerne le médicament qui fonctionne le mieux pour traiter la dégénérescence maculaire. Comme aucune Grande Étude n’a été achevée, la question reste sans réponse.,
« des dizaines de milliers de doses D’Avastin ont été administrées dans tout le pays, alors que les médecins attendaient que le ranibizumab soit approuvé », a écrit Edwin M. Stone, MD, PhD, chercheur au Howard Hughes Medical Institute de L’Université de L’Iowa, dans un éditorial publié dans le numéro d’octobre 2006 du New England Journal of Medicine. « Et cela a souvent très bien fonctionné. Mais ce que personne ne sait pour le moment, c’est si un médicament est vraiment nettement meilleur que l’autre. »
L’éditorial a noté que Lucentis coûte plus de 2 000 per par traitement, tandis Qu’Avastin coûte moins de 150 per par traitement., Cet écart de prix pourrait être très important pour les personnes qui ont une couverture d’assurance maladie limitée ou inexistante.
l’article du New England Journal of Medicine souligne que Medicare couvre les injections de Lucentis en vertu de la partie B du plan, mais que la co-rémunération de 20% requise pour chaque injection mensuelle représente toujours une dépense importante. Une assurance complémentaire pourrait être disponible pour couvrir au moins certains coûts liés aux co-paiements.
Medicare au début de 2010 fournit un remboursement de 50 when par injection lorsque Avastin est utilisé pour les traitements de dégénérescence maculaire., À la fin de 2009, les ophtalmologistes ont réussi à faire pression pour renverser une nouvelle directive de L’assurance-maladie qui réduisait les remboursements d’Avastin de 50 $à 7 per par injection. L’action de Medicare a temporairement forcé les ophtalmologistes à utiliser Lucentis au lieu d’Avastin.
Mais si vous faites le calcul, Avastin pourrait toujours être l’alternative la moins chère même pour les personnes couvertes par Medicare ou l’assurance maladie lorsqu’une co-paiement de 20 pour cent équivaut à environ 400 per par traitement pour Lucentis, contre 150 per par traitement pour Avastin.,
encore une fois, l’assurance complémentaire peut être en mesure de réduire les dépenses personnelles associées aux traitements Lucentis.
en mai 2007, des chercheurs britanniques ont publié une analyse des coûts comparant les deux traitements dans le British Journal of Ophthalmology. Les chercheurs ont conclu que Lucentis, qui est environ 50 fois plus cher que L’Avastin, devrait être 2,5 fois plus efficace pour justifier le coût supplémentaire. Les chercheurs ont indiqué que Lucentis, comparé à Avastin, ne semble pas être aussi rentable.,
en savoir plus sur Lucentis et Avastin
Lucentis et Avastin sont tous deux produits par la même société — Genentech, basée à San Francisco. Mais il existe des différences entre les deux médicaments.
Lucentis est administré sous forme de molécules plus petites, ce qui est censé donner à Lucentis un avantage sur L’Avastin dans sa capacité à pénétrer la rétine de l’œil et à stopper la croissance anormale des vaisseaux sanguins contribuant à la dégénérescence maculaire Avancée et aux cicatrices qui provoquent la cécité.,
Les responsables de la société Genentech ont déclaré à plusieurs reprises aux journalistes que des dépenses considérables avaient été engagées dans le développement du Lucentis comme traitement de la dégénérescence maculaire et dans le financement d’essais cliniques prouvant l’innocuité et l’efficacité du médicament.
Les responsables de Genentech ont déclaré qu’ils n’avaient pas l’intention de financer également des essais cliniques pour Avastin en tant que traitement de la dégénérescence maculaire, maintenant que Lucentis a reçu l’approbation de la FDA et que la nécessité d’un traitement efficace de la dégénérescence maculaire a été satisfaite.
au Lieu de cela, états-UNIS, des fonds publics sont utilisés pour comparer l’efficacité et l’innocuité des deux traitements. Au début de 2008, des plans ont été annoncés pour l’inscription de participants aux essais comparatifs sur deux ans des traitements de la dégénérescence maculaire liée à l’âge (CATT), parrainés par le National Eye Institute dans 43 sites d’étude.
où se situe maintenant le débat Lucentis-Avastin
dans le passé, de graves préoccupations en matière d’innocuité ont été exprimées au sujet de L’utilisation non indiquée sur l’étiquette d’Avastin comme traitement de la dégénérescence maculaire., C’est en partie parce que la FDA en janvier 2005 a averti que L’Avastin, lorsqu’il est utilisé pour traiter le côlon et d’autres cancers, augmente considérablement le risque d’accident vasculaire cérébral, de crise cardiaque et d’autres événements indésirables liés à la santé.
cependant, le British Journal of Ophthalmology en juillet 2006 a rapporté les résultats d’une enquête Internet auprès des ophtalmologistes qui n’ont signalé aucun effet secondaire indésirable sur la santé lié à L’utilisation D’Avastin pour la dégénérescence maculaire, apparemment parce que des doses relativement faibles du médicament sont injectées dans l’œil.,
mais d’autres chercheurs commentant dans la revue soulignent que les risques de sécurité à long terme de L’Avastin restent inconnus. Pour le traitement du cancer, des doses plus élevées D’Avastin sont administrées par perfusion intraveineuse (IV) dans une veine sanguine, par exemple dans le bras.
« Actuellement, il semble y avoir un consensus mondial selon lequel la stratégie de traitement utilisant l’Avastin intravitréen est logique, les risques potentiels pour nos patients sont minimes et la rentabilité est si évidente que le traitement ne devrait pas être retenu », Philip J., Rosenfeld, MD, PhD, du Bascom Palmer Eye Institute de Miami a écrit dans un éditorial publié dans le numéro de juillet 2006 de L’American Journal of Ophthalmology.
Dans un commentaire publié dans le numéro d’octobre 2006 du British Journal of Ophthalmology, des chercheurs britanniques de Liverpool ont noté que Lucentis a été développé pour le traitement de la dégénérescence maculaire en raison de la crainte que L’Avastin ne soit pas capable de pénétrer efficacement la rétine de l’œil.,
Les auteurs britanniques ont noté que les responsables de Genentech ont suivi le protocole correct et ont entrepris les dépenses et les recherches nécessaires pour s’assurer qu’un traitement efficace, Lucentis, était entièrement testé spécifiquement comme traitement de la dégénérescence maculaire.
Le commentaire Britannique pesait sur les deux côtés de la question : » Est-il juste que Genentech perde? Qu’en est-il des patients (ou des pays) qui n’ont pas les moyens de se payer Lucentis? Est-il juste que le traitement ne soit disponible que pour ceux qui sont riches? »
Ces questions soulignent la complexité de la controverse.,
des chercheurs en médecine impliqués dans le débat ont proposé que davantage d’enquêtes soient menées pour déterminer si moins de doses impliquant à la fois Lucentis et Avastin pourraient obtenir les mêmes résultats positifs, contribuant ainsi à réduire les coûts de traitement. Des recherches explorent également l’efficacité de la combinaison de Lucentis avec d’autres thérapies pour réduire la fréquence des doses.,
dans une petite étude rapportée en 2008, les chercheurs de Munich ont constaté que Lucentis était légèrement meilleur Qu’Avastin lorsqu’il était utilisé comme traitement supplémentaire pour les personnes atteintes de DMLA Avancée et qui avaient besoin de plus d’injections oculaires après avoir reçu des traitements Avastin initialement.
de plus, dans ce qui pourrait être un incident isolé, Genentech a signalé à la fin de 2008 que l’utilisation non indiquée sur l’étiquette D’Avastin avait provoqué une éclosion d’inflammation oculaire grave dans quatre centres canadiens où des personnes avaient reçu des injections oculaires pour la dégénérescence maculaire.,
la façon dont L’Avastin est formulé pourrait également être associée à certains cas de pression oculaire élevée après les injections, a déclaré un présentateur lors d’une conférence de L’AAO 2009.
Une petite étude rapportée en octobre 2009 n’a trouvé aucune différence d’efficacité entre Avastin et Lucentis, selon les chercheurs de la Boston University School of Medicine (BUSM) et du va Boston Healthcare System.
dans un rapport de suivi annoncé en octobre 2010, les mêmes chercheurs n’ont noté aucune différence significative dans les résultats sur un an entre les groupes Lucentis et Avastin étudiés.,
cependant, les chercheurs affirment que les différences de coût pour les personnes recevant un traitement sont majeures à environ 40 per par injection pour Avastin et 2 000 per par injection pour Lucentis.
Le débat Lucentis-Avastin peut être réglé lorsque les essais cliniques NEI de deux ans comparant les deux traitements seront terminés. L’inscription à L’étude CATT a pris fin au début de 2010 et les résultats de la première année ont été communiqués en mai 2011.** La conclusion préliminaire est que les deux médicaments sont à peu près égaux dans leur efficacité, mais les mesures de sécurité et les effets à long terme seront étudiés plus avant au cours de la deuxième année de CATT.,
