la Notation D et L pour la Configuration absolue des sucres et des acides aminés
Qu’est-ce qui différencie le « D-Glucose” du « L-Glucose” ? Ou D-alanine de L-alanine?
et quelle est cette nomenclature D et L, de toute façon? Lisez la suite:
table des matières
- D – et l – fournit un raccourci rapide pour désigner les énantiomères
- pourquoi nous Embêtons-nous avec cette ancienne Nomenclature?,
- Le système L – Et D pour attribuer une « Configuration absolue »
- quatre aldéhydes De Carbone D-et l – sucres (Aldotétroses)
- cinq aldéhydes De Carbone D-et l – sucres (Aldopentoses)
- six aldéhydes De Carbone D – et l-sucres (Aldohexoses)
- Mais attendez – il y a plus! (Acides aminés)
- résumé: Notation D – et L pour les sucres et les acides aminés
- Notes
- (avancé) références et autres lectures
D – et L – fournit un raccourci rapide pour désigner les énantiomères
la notation D – et l fournit un raccourci rapide pour désigner les énantiomères.,
Le D-Glucose est l’énantiomère du L-Glucose, par exemple. Comme la L-Alanine est l’énantiomère de la D-Alanine.
Il est attribué comme suit. Pour un sucre tiré dans la projection de Fischer avec le carbone le plus oxydé en haut (c’est – à – dire l’aldéhyde ou la cétone)
- si le OH du centre chiral inférieur pointe vers la droite, on parle de D –
- si le OH du centre chiral inférieur pointe vers la gauche, on parle de L -.
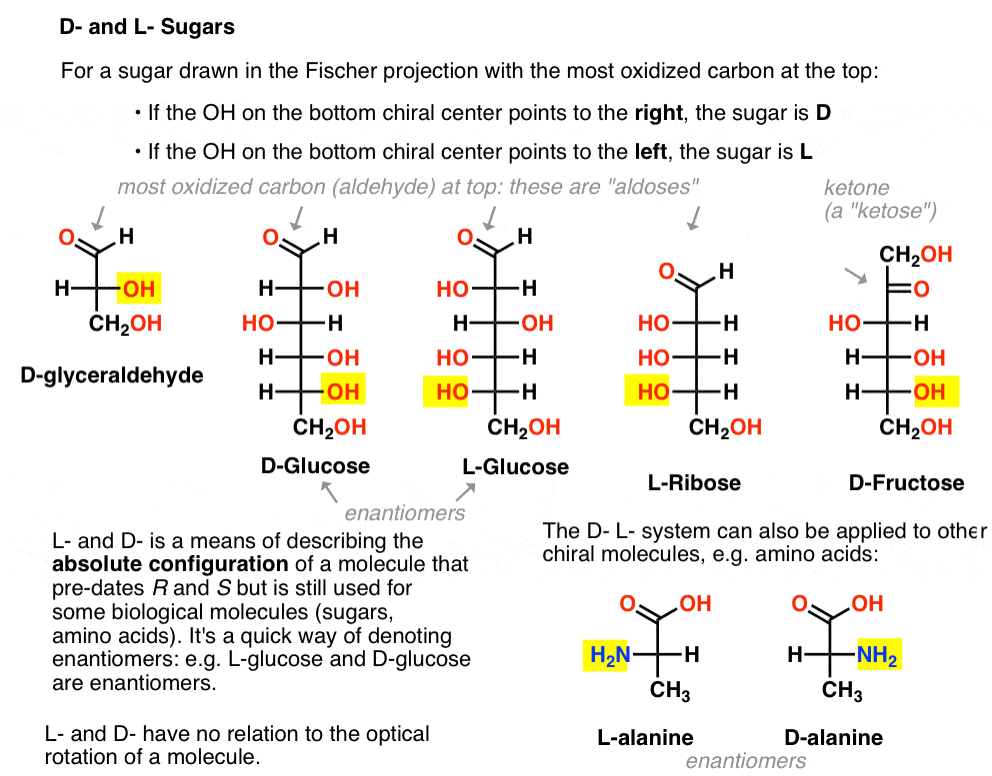
Cette terminologie peut également être appliquée à des acides aminés: voir L – et D – alanine dans l’image ci-dessus.,
2. Pourquoi Nous Embêtons – Nous Avec Cette Ancienne Nomenclature?
vous pourriez à juste titre demander: n’avons-nous pas déjà un système pour attribuer une configuration absolue ? Pourquoi avons-nous besoin d’un nouveau système?
Le Système D-L n’est pas un nouveau système, les gens. C’est l’ancien système – il est antérieur à Cahn-Ingold-Prelog.
Le Système D-L est littéralement un vestige de l’ère du cheval et du buggy, remontant aux travaux d’Emil Fischer sur les glucides à la fin des années 1800-une époque où les chimistes organiques n’avaient aucun moyen de déterminer la configuration absolue des stéréocentres, ce qui n’est devenu possible qu’en 1951 (thx, Bijvoet).,
alors pourquoi est-il encore utilisé? Ne devrait-il pas être consigné dans la poubelle de l’histoire, avec des règles à glissière, des cassettes 8 pistes et des disquettes 5¼”?
Eh bien, il y a des communautés florissantes dans certaines parties de l’Amérique rurale où les calèches persistent-si vous savez où chercher. (Peut-être qu’un jour il y aura des communes où les gens n’utilisent que la technologie informatique des années 1970 et 1980?)
de même, il existe une poche de chimie organique où le système D-L trouve encore une utilisation, et qui est spécifiquement dans le domaine des sucres et des acides aminés.,
ce n’est pas une révolte des chimistes Amish contre les maux modernes du système CIP, soit dit en passant. Il y a au moins 3 bonnes raisons, dans le cas spécifique des sucres et des acides aminés, d’utiliser L – et D- :
- brièveté. Le D-glucose est beaucoup plus rapide à écrire et à dire que (2R,3S,4R,5R)2,3,4,5,6-pentahydroxyhexanal. Le système L – / D-permet de résumer la configuration d’une molécule à plusieurs centres chiraux par une seule lettre (plus son nom commun, bien sûr – merci à Noel pour le rappel)
- plus de brièveté., Il se trouve être un moyen rapide de se référer aux énantiomères. L’énantiomère du L-glucose est le D-glucose. L’énantiomère du L-tryptophane est le D-tryptophane. Et alors que nous pourrions utiliser les préfixes (+)- ou (–)- pour différencier les deux énantiomères du glucose et d’autres sucres, le signe de rotation optique peut varier avec le solvant, la température, la concentration et d’autres facteurs, ce qui le rend moins qu’idéal. De plus, L – Et D – se réfèrent spécifiquement à la configuration absolue, alors que (comme nous l’avons noté précédemment) il n’y a pas de relation simple entre le signe de rotation optique et la configuration.,
- Il s’avère que la plupart des sucres naturels sont D-, et la plupart des acides aminés naturels sont L- . Il y a une énorme quantité d’informations compressées dans cette déclaration, et il n’y a pas de système concurrent (R/S, +/–) qui pourrait remplacer le L – et le D – par un seul caractère. Note
il convient de répéter: avec les sucres et les acides aminés, L – Et D – peuvent être des désignations utiles. Pour d’autres molécules, vous pouvez largement l’oublier.
alors, quel est ce système D/L, et comment ces termes se rapportent-ils à la structure?,
Rejoignez – moi pour voyager dans le temps
le système L Et D pour L’attribution de la « Configuration absolue”
Emil Fischer a commencé à étudier les glucides à la fin des années 1880. on savait à cette époque (via Van’t Hoff) que le carbone était tétraédrique, et on savait également que les molécules contenant un carbone avec quatre substituants différents pouvaient faire pivoter la lumière polarisée plane (par exemple Pasteur). Ce qui n’était pas connu était la configuration absolue de l’une des molécules chirales – ce que nous appellerions aujourd’hui leurs configurations « R” et « S”.,
le glucide le plus simple contenant un centre chiral est le glycéraldéhyde, C3H6O3. Le glycéraldéhyde a trois carbones; ce qui en fait un « triose”. Le carbone le plus oxydé dans le glycéraldéhyde est un aldéhyde, ce qui en fait également un « aldose”.
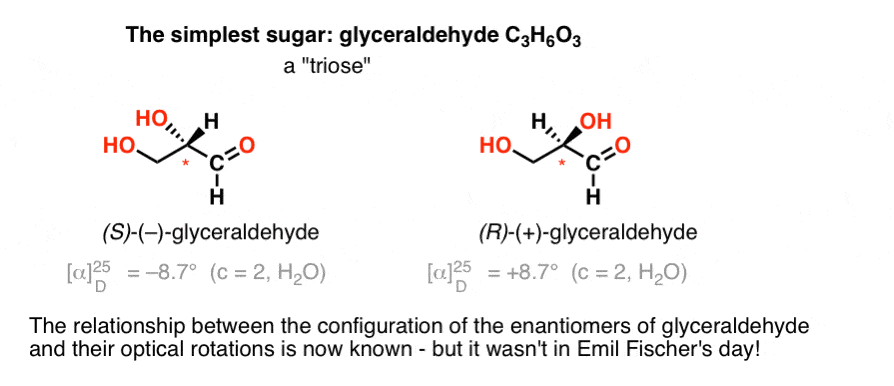
En 1888, les deux énantiomères de la glycéraldéhyde avait été isolé et caractérisé., Mais comme il n’y a pas de corrélation simple entre la configuration d’un centre chiral et la direction dans laquelle il tourne la lumière polarisée plane, Emil Fischer n’avait aucun moyen de lier la rotation optique du ( + )-et du ( – ) –glycéraldéhyde à la configuration absolue des atomes autour du centre chiral.
En utilisant la terminologie d’aujourd’hui, il n’avait aucun moyen de savoir si le (–)-glycéraldéhyde était (R) ou (S).
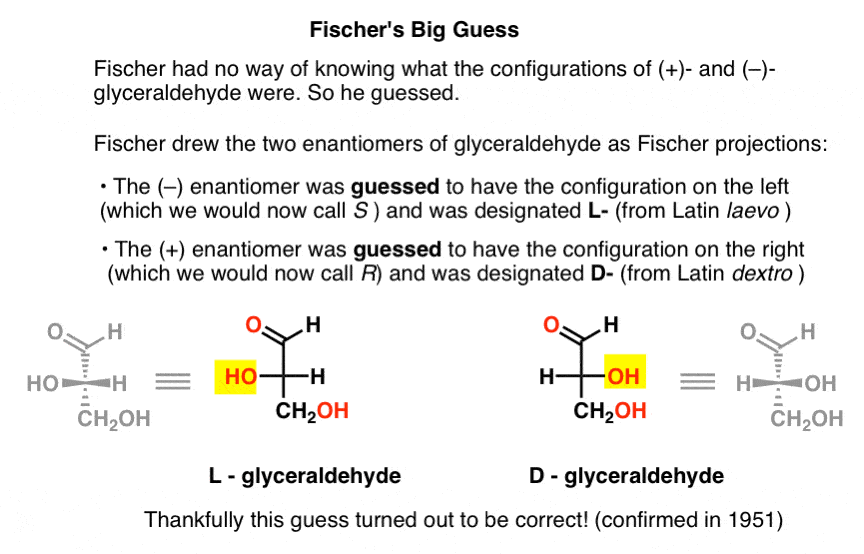
manquant de cette information clé, Fischer a choisi de deviner.,
la supposition, qui s’est avérée correcte, était que (–)-glycéraldéhyde avait la configuration que nous appelons maintenant S, et que (+)-glycéraldéhyde avait la configuration que nous appelons maintenant R.
Bien sûr, Cahn, Ingold et Prelog n’étaient pas encore nés, et le système CIP ne serait développé qu’après les travaux de Bijvoet en 1951. Fischer a donc développé sa propre nomenclature.
dessinant le glycéraldéhyde dans ce qui sera appelé plus tard la projection de Fischer, il a attribué la configuration à gauche au (–)-glycéraldéhyde, et l’a appelé L- (abréviation du latin laevo )., Il a ensuite attribué la configuration à droite à ( + ) – glycéraldéhyde, et l’a appelé D – (pour latin dextro).
Pourquoi est-ce si important?
attribuer la configuration absolue pour le L – et le d – glycéraldéhyde était un peu comme attribuer le méridien principal (0° de longitude) à L’Observatoire Royal de Greenwich, en Angleterre., Tout comme la longitude de tout autre endroit sur Terre pourrait alors être déterminée par rapport à ce point si leurs distances relatives étaient connues, la configuration absolue de tout autre stéréocentre pourrait alors être déterminée si sa configuration par rapport à L – ou d – glycéraldéhyde était connue.
Ce n’est peut-être pas l’analogie la plus claire. Regardons donc les sucres à 4 carbones pour un autre exemple.,
quatre aldéhydes De Carbone D – et l – sucres (Aldotétroses)
Une fois les configurations absolues de l – et d – glycéraldéhyde proposées, les configurations absolues d’autres composés chiraux pourraient alors être établies par analogie (et beaucoup de travail de grognement chimique).
Ce n’est pas crucial pour aujourd’hui, mais pour un exemple de ce type de raisonnement, de voir cela .
lorsque le concept de centres chiraux était introduit, vous avez probablement appris qu’une molécule avec n centres chiraux aura 2N stéréoisomères (tant qu’il n’y a pas de composés méso).,
Il existe deux aldoses à quatre carbones, le thréose et l’érythrose. Ils ont chacun deux centres chiraux. Chacun existe sous la forme d’une paire d’énantiomères (L – et D- ) donnant quatre stéréoisomères au total.
ils sont Ici. La chose importante à noter dans la figure ci-dessous est que la famille L des sucres a le groupe OH du carbone chiral inférieur à gauche, et la famille D A le groupe OH du carbone chiral inférieur à droite (surligné).,
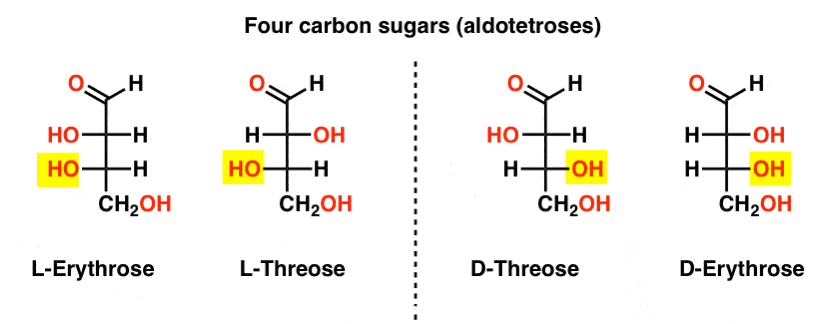
voyez comment le l-érythrose et le L-Thréose s’appuient sur le stéréocentre établi dans le l-glycéraldéhyde (surligné), et le D-érythrose et le D-Thréose s’appuient sur le stéréocentre établi dans le d-glycéraldéhyde (surligné).
Les sucres sont construits un peu comme le système binaire; vous pouvez penser que chaque stéréocentre est un « bit” qui peut avoir l’une des deux valeurs. La configuration du l-érythrose et du l-thréose ne diffère que dans un stéréocentre. Si nous retournions la position de H et OH, nous obtiendrions l’autre., Cette relation a un nom que vous pouvez parfois voir: deux molécules qui ont la configuration opposée à un seul stéréocentre sont appelées épimères, en particulier lorsque l’un des atomes attachés au stéréocentre est un hydrogène (H).
cinq aldéhydes De Carbone D – et l – sucres (Aldopentoses)
le nom le plus familier sur cette liste devrait être le ribose, qui est l’épine dorsale du sucre de l’acide ribonucléique (ARN).
sur le côté gauche du diagramme ci-dessous, nous avons les l-aldopentoses, qui partagent toutes la même configuration du stéréocentre inférieur lorsque l’aldéhyde est placé en haut.,
leurs énantiomères, les d-aldopentoses, sont sur le côté droit, qui partagent tous la même configuration du stéréocentre inférieur (surligné).
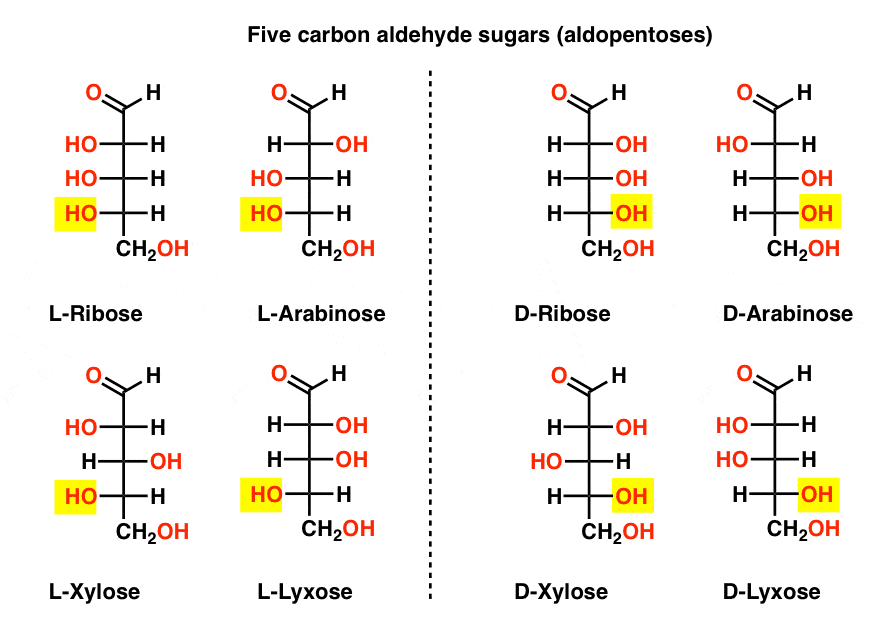
à ce stade, nous devons souligner que l’écrasante majorité des sucres dans les formes de vie terrestres sont des sucres D, y compris le D-ribose comme colonne vertébrale de L’ARN. Pourquoi et comment tous les organismes sur terre se sont retrouvés avec des sucres D est un mystère, car on suppose que les sucres L auraient tout aussi bien fonctionné.,
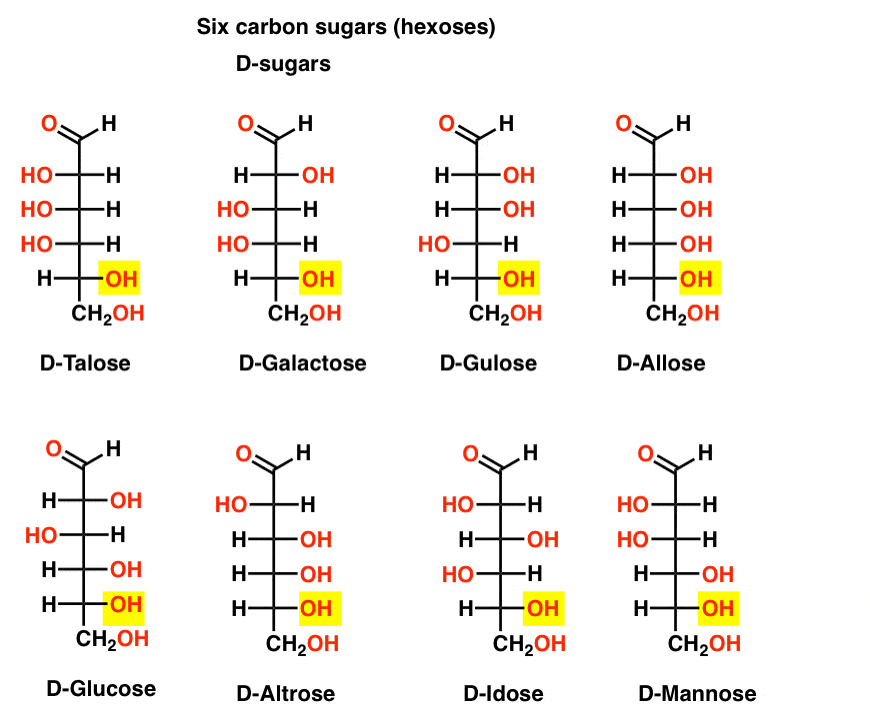
six aldéhydes De Carbone D – et l – sucres (Aldohexoses)
S’il y a 4 aldopentoses, chacune sous la forme D’une paire D – L d’énantiomères (8 stéréoisomères au total), alors combien y a – t-il d’aldohexoses?
il y a 8 paires D-L (16 stéréoisomères au total). Le plus familier est le glucose, mais vous reconnaîtrez probablement le mannose et le galactose. Certains sont rarement, voire jamais, dans la nature (idose, n’importe qui?).
Voici les d-aldohexoses. Notez qu’ils ont tous la même configuration du centre chiral inférieur – la même que celle que nous avons vue dans le d-glycéraldéhyde.,
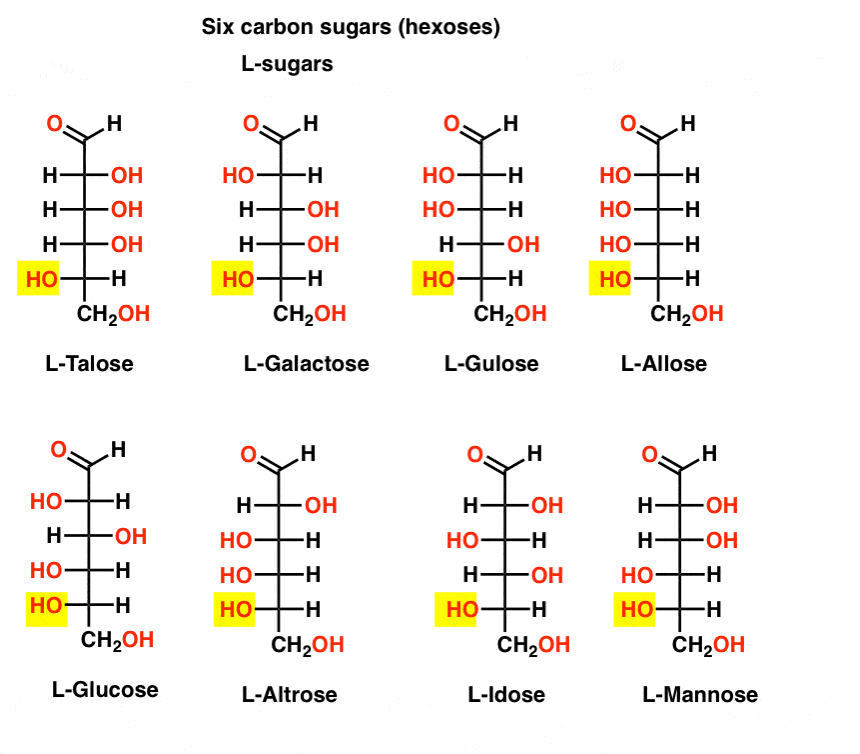
Contrairement aux sucres D, les sucres L (ci-dessous) se trouvent rarement dans la nature. Fait intéressant, le L-glucose a été exploré comme substitut du sucre. Son goût est indiscernable du D-glucose naturel, mais ne fournit aucune nourriture car il ne peut pas être décomposé par nos enzymes (chirales). Il s’avère que la production est tout simplement trop chère pour rivaliser avec splenda, stevia, aspartame et. Al.
OK, c’est assez. Des sucres à sept carbones ont été fabriqués (aldoheptoses) mais ils ne sont pas biologiquement significatifs.,
7. Mais attendez – il y a plus! (Acides aminés)
Si vous dessinez des acides aminés dans la projection de Fischer avec le groupe le plus oxydé en haut (l’acide carboxylique), vous pouvez également attribuer L – et D-.
Des 19 acides aminés chiraux qui sont incorporés dans les protéines (protéinogène est le terme approprié) sont tous L- . (La Glycine est achirale, donc D – et L-ne s’appliquent pas). Certains acides D-aminés sont naturels, mais ils sont rares (principalement présents dans les bactéries, à l’exception notable du venin d’ornithorynque) et ne sont pas codés par l’ARNm.,
fait intéressant, bien que les 19 acides aminés chiraux soient L- , seuls 18 des 19 sont (S). Quelle est l’exception?
(c’est bon trivia de barre de chimie organique).
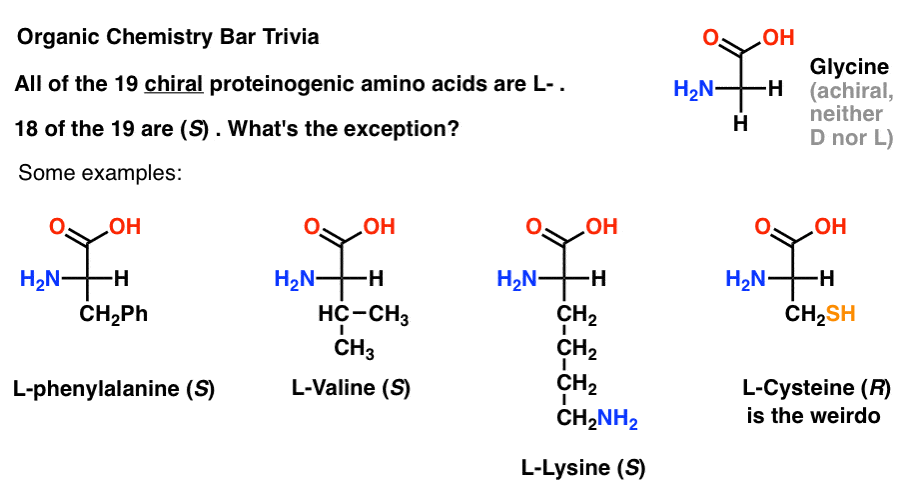
la Cystéine est la weirdo.
(points Bonus si vous avez également dit sélénocystéine NER nerd).
résumé: Notation D et L pour les sucres et les acides aminés
c’est donc le système D – L pour l’attribution de la configuration absolue. Cela fonctionne bien pour les sucres car ils peuvent être construits de manière systématique (comme le système binaire). Il est également utile pour les acides aminés., Le point clé est juste de regarder le stéréocentre inférieur pendant qu’il est dessiné dans la projection de Fischer. Droit? D. À Gauche? L.
Bien sûr, les sucres ne sont pas toujours si utilement dessinés dans les projections de Fischer – ils forment des anneaux. Nous écrirons sur la détermination de D – et L – dans les sucres cycliques dans un prochain article.
Tout ce que j’ai à dire, c’est remercier la divinité en laquelle vous avez choisi de croire que la supposition de Fischer s’est avérée correcte. Ce serait une énorme douleur dans le cul de passer au crible 70+ années de la littérature chimique sachant que la mauvaise configuration avait été attribuée à tous les sucres et acides aminés.,
Merci à Thomas Struble pour son aide dans ce post.
Notes
Note 1. « l’avant-dernier stéréocentre dans la plupart des sucres chiraux est R, tandis que le stéréocentre dans la plupart des acides aminés est S” n’a pas tout à fait le même anneau, d’autant plus que la cystéine est R. ]
Remarque. Voici une expérience de pensée pour déterminer les configurations relatives de l’érythrose et du thréose., (Je dis « expérience de pensée » parce que je ne veux pas inclure de réactifs spécifiques, ce qui pourrait être distrayant)
Si l’on commence par du (+)-érythrose pur et oxyde l’alcool primaire en un aldéhyde en utilisant des méthodes connues, on obtient un composé dépourvu de rotation optique. Il en va de même pour le (–)-érythrose, qui renvoie un composé complètement identique. On peut en déduire que la structure du nouveau composé doit être telle que la molécule ait un plan miroir interne (c’est-à-dire qu’elle est méso). .,
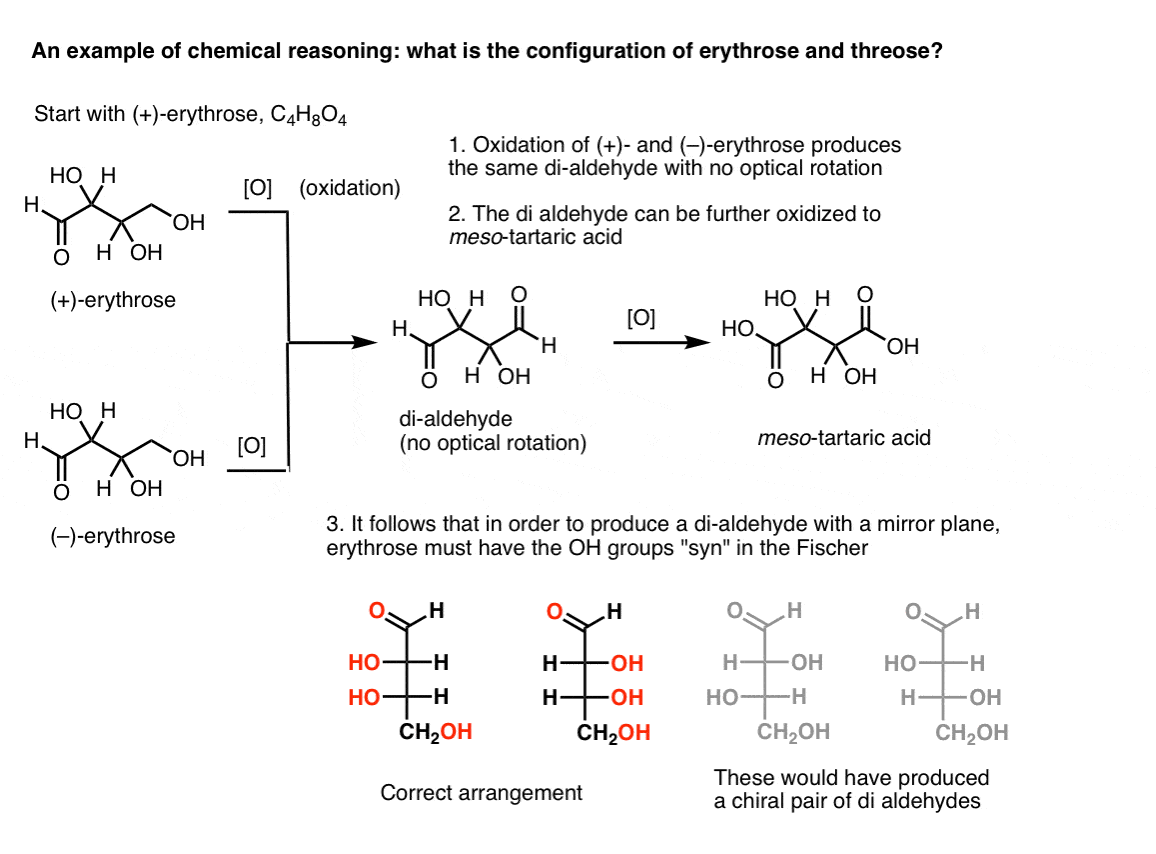
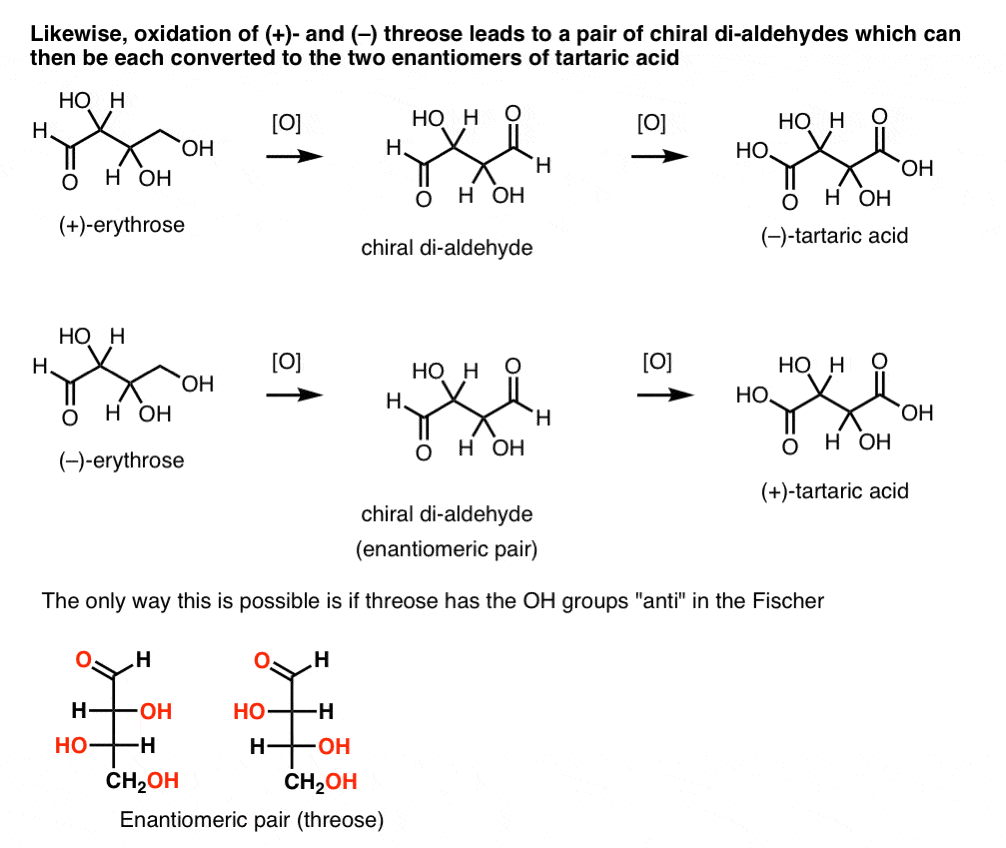
en revanche, l’exécution de la même opération sur (+)-threose entraîne un di-aldéhyde qui maintient la rotation optique. Un composé à rotation optique égale et opposée est formé en effectuant la même opération sur ( – ) – thréose. Ces deux composés sont des énantiomères. Pour que cela soit vrai, l’orientation relative des groupes hydroxyle dans thréose doit être anti. Ces composés peuvent être oxydés davantage pour produire, respectivement, de l’acide ( – ) – et ( + ) – tartrique.,
Le même raisonnement peut être utilisé dans le sens inverse (de réduction). Par exemple, l’érythrose ( + ) – ou (-) – peut être réduite en érythritol tétra-ol, qui est méso.
de même, la réduction du (+)- et du (–) thréose donne une paire énantiomérique de tétra-ols, le thréitol.
de ces faits, nous pouvons déduire l’orientation relative des groupes OH.
(avancé) références et lectures complémentaires
- Über die Bezeichnung von optischen Antipoden durch die Buchstaben d und l
Emil Fischer
Ber. 1907, 40 (1), 102-106
DOI: 10.,1002 / cber.19070400111
Ceci est le célèbre papier où Prof. Emil Fischer (arbitrairement!) attribué (-)-glycéraldéhyde la L-stéréochimie. - synthèses dans le groupe des purines et du sucre
Emil Fischer
conférence Nobel, 1902La Conférence Nobel de Fischer, où il parle de son travail non seulement dans les glucides, mais aussi dans les purines, dont des composés comme la caféine et la théobromine sont membres. Le professeur Fisher prédit l’augmentation des boissons énergisantes (p. ex., Red Bull), déclarant : » avec l’exercice d’un peu d’imagination, on peut prévoir le jour où les haricots ne seront plus nécessaires pour faire un bon café: une petite quantité de poudre d’un produit chimique fonctionne avec de l’eau fournira une boisson savoureuse et rafraîchissante étonnamment bon marché”.
- détermination de la Configuration absolue des composés optiquement actifs au moyen de rayons X
BIJVOET, J., PEERDEMAN ,A. & van BOMMEL, A.,
Nature 1951, 168, 271-272
DOI: 1038 / 168271a0
Le célèbre article qui a prouvé, en utilisant l’analyse structurelle aux rayons X, que « la convention D’Emil Fischer, qui a attribué la configuration de la Fig. 2 à l’acide dextrorotatoire, semble répondre à la réalité ». - découverte par Emil Fischer de la configuration du glucose. A semicentennial retrospect
C.S. Hudson
Journal of Chemical Education 1941, 18 (8), 353
DOI: 10.1021/ed018p353
Une première revue qui couvre les travaux du Professeur Emil Fischer en chimie des glucides., - La preuve de la Configuration des sucres D’Emil Fischer: un hommage centenaire
Frieder W. Lichtenthaler
Angew. Chem. Int. Ed. 1992, 31 (12), 1541-1556
DOI: 10.1002/anie.199215413
Une revue très lisible de 1992 qui couvre les travaux du Professeur Fischer en chimie des glucides et approfondit les attributions stéréochimiques des glucides.
