exemple – prédire la polarité moléculaire:
déterminez si les molécules représentées par les formules suivantes sont polaires ou polaires. (Vous devrez peut-être dessiner des structures Lewis et des croquis géométriques à doso.
a. CO2 B. OF2 C. CCl4 D. CH2Cl2 E. HCN
Solution:
A. La structure de Lewis pour le CO2 est
Les ÉLECTRONÉGATIVITÉS du carbone et de l’oxygène sont de 2,55 et 3,44. Le 0.,89 la différence d’électronégativité indique que les liaisons EC-O sont polaires, mais la disposition symétrique de ces liaisons rend la molécule non polaire.
Si nous mettons des flèches dans l’esquisse géométrique pour le CO2, nous voyons qu’elles s’équilibrent exactement, dans les deux sens etmagnitude. Cela montre la symétrie des liaisons.
b., La structure de Lewis pour OF2 est

Les électronégativités de l’oxygène et du fluor,3,44 et 3,98, respectivement, produisent une différence de 0,54 qui nous amène à prédire que les liaisons O-F sont polaires. La géométrie moléculaire de OF2 est courbée. Une telle distribution asymétrique des liaisons polaires produirait une molécule polaire.
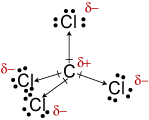
c. La géométrie moléculaire de CCl4 istetrahedral., Même si les liaisons C-Cl sont polaires, leur arrangement symétrique rend la molécule non polaire.
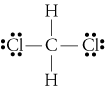
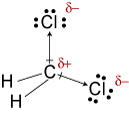
d. TheLewis structure de CH2Cl2 est
Le electronegativities de l’hydrogène, du carbone, de andchlorine sont 2.20, 2.55, et 3.16. La différence de 0,35 dans l’électronégativité pourles liaisons H-C nous dit qu’elles sont essentiellement non polaires. Le 0.,61la différence d’électronégativité pour les liaisons C-Cl montre qu’elles sont polaires. Les croquis géométriques suivants montrent que les zones de liaisons polairesassemblé symétriquement, de sorte que la molécule est polaire. (Notez que la structure de Lewisstructure ci-dessus suggère incorrectement que les liaisons sont disposées symétriquement.Gardez à l’esprit que les structures de Lewis donnent souvent une fausse impression de la géométriedes molécules qu’elles représentent.)

e., Cette structure et cette esquisse géométrique pour HCN sont les mêmes:

Les électronégativités de l’hydrogène,du carbone et de l’azote sont de 2,20, 2,55 et 3,04. La différence de 0,35 dansélectronégativité pour la Liaison H-C montre qu’elle est essentiellement non polaire. La différence de 0,49 dans l’électronégativité pour la liaison C-N nous dit qu’elle est polaire.Les molécules avec une liaison polaire sont toujours polaires.