trifluorure D’azote propriétés chimiques,utilisations,Production
Description
le trifluorure d’azote est un gaz incolore avec peu d’odeur. Le trifluorure d’azote est un oxydant qui est alorsdynamiquement stable sauf à des températures élevées. À des températures allant jusqu’à environ 482 ° F (250°C), sa réactivité est comparable à celle de l’oxygène. À des températures plus élevées, sa réactivité est similaire à celle du fluor en raison d’une dissociation appréciable en NF2 et F-., La dissociation thennal du trifluorure d’azote a été étudiée par un certain nombre d’investigateurs et a été trouvée pour culminer dans la gamme de température de 1100K à 1500k. en manipulant le trifluorure d’azote, les conditions devraient être évitées qui peuvent entraîner des températures élevées telles que la compression adiabatique de la pressurisation rapide d’un système.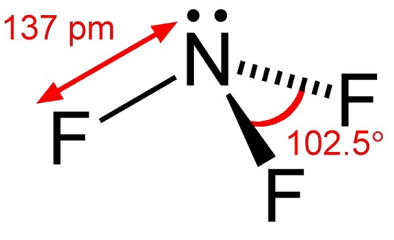
le trifluorure d’azote agit principalement sur les éléments en tant qu’agent fluorant, mais pas très actif à basse température., À des températures élevées, le trifluorure d’azote se pyrolyse avec de nombreux éléments pour produire du tétrafluorure d’azote et le fluorure correspondant. La pyrolyse du trifluorure d’azote sur les tournures de cuivre produit du tétrafluorure d’azote avec un rendement de 62 à 71% à 375°C (707°f). La pyrolyse sur le carbone est plus complète.
propriétés chimiques
le trifluorure d’azote est un gaz incolore. Moldyodor. Expédié sous forme de gaz comprimé non liquide.
Propriétés physiques
gaz incolore; odeur moisie; liquéfie à -128,75°C; Densité du liquide 3.,116 g/mL; Pression de vapeur à -158 ° c 96 torr; se solidifie à -206,8°C; température critique -39,15°C; Pression critique 44,02 atm; volume critique 126 cm3/mol; très légèrement soluble dans l’eau.
utilise
le trifluorure d’azote est un agent de nettoyage de la chambre et de l’eau-forte.
oxydant pour les carburants à haute énergie, synthèse chimique.
utilisations
le trifluorure d’azote est un gaz composé d’atomes d’azote et de fluor., L’industrie électronique mondiale utilise le trifluorure d’azote dans ses processus de nettoyage, car le gaz surpasse les autres alternatives, est plus facile et plus sûr à manipuler et contribue à réduire les émissions de gaz à effet de serre.
Les fabricants de semi-conducteurs, de cellules solaires à couche mince et d’écrans plats utilisent du trifluorure d’azote pour nettoyer les chambres de traitement. À l’intérieur des chambres, de fines couches de films semi-conducteurs et isolants sont appliquées sur les plaquettes et les panneaux., Le trifluorure d’azote élimine les résidus que ces films laissent sur les parois de la chambre afin que les chambres puissent fonctionner efficacement et produire un dispositif de qualité.
le trifluorure d’azote offre de nombreux avantages par rapport aux agents de nettoyage alternatifs. Il est stable à température ambiante, il est donc relativement facile et sûr à manipuler. Il est également facile d’utiliser du trifluorure d’azote pour former un gaz énergétique ou réactif ou un plasma—un gaz à électrons libres. La durée de vie relativement longue des radicaux fluor fabriqués dans le plasma fait du trifluorure d’azote un nettoyant efficace.,
utilise
le trifluorure d’azote a été utilisé avec succès en grandes quantités comme source de fluor pour les lasers chimiques à haute énergie. Il est préféré overfluorine en raison de sa facilité comparative de manipulation dans des conditions ambiantes.
récemment, une quantité croissante de nitrogentrifluorure est utilisée dans l’industrie des semi-conducteurs comme agent de gravure sec, montrant des taux de gravure et des sélectivités significativement plus élevés par rapport au tétrafluorure de carbone et aux mélanges de tétrafluorure de carbone et d’oxygène.,
le trifluorure D’azote a également été utilisé comme oxydant dans les fusées au début des années 1960, mais cette application n’a pas été commercialisée.
préparation
le trifluorure d’azote est préparé par électrolyse de fluorure d’ammonium fondu, NH4F, ou de fluorure d’acide d’ammonium fondu, NH4HF2 (ou de fluorure d’ammonium dans HF anhydre). Alors que la méthode NH4F est préférée car elle forme du trifluorure d’azote comme seul produit, l’électrolyse du fluorure d’acide d’ammonium donne une petite quantité de difluorure de dinitrogène, de N2F2 et de NF3.,
de plus, le trifluorure d’azote peut être préparé par réaction d’ammoniac avec du fluor dilué avec de l’azote dans un réacteur emballé avec du cuivre. D’autres fluorures d’azote, tels que N2F2, N2F4 et NHF2 sont également produits. Le rendement du produit principal dépend du rapport fluor / ammoniac et d’autres conditions.
méthodes de Production
le trifluorure d’azote peut être formé à partir d’une grande variété de réactions chimiques. Le processus commercial de production implique la fluoration directe de l’ammoniac avec du fluor gazeux en présence defluorure d’ammonium.,
réactions
L’hydrogène réagit avec le trifluorure d’azote avec la libération rapide de grandes quantités de chaleur et est à la base de l’utilisation du trifluorure d’azote dans les lasers chimiques à haute énergie. L’inflammabilité plage de trifluorure d’azote-hydrogène mélanges est de 9,4 mole pour cent à 95 mole pour cent de trifluorure d’azote. Le trifluorure d’azote réagit avec les composés organiques, mais généralement une température élevée est nécessaire pour initier la réaction., Dans ces conditions, la réaction se déroulera souvent de manière explosive, et un grand soin doit être apporté lors de l’exposition du trifluorure d’azote à des composés organiques. Par conséquent, le trifluorure d’azote a trouvé peu d’utilisation comme agent de fluoration pour les composés organiques.
Description générale
un gaz incolore avec une odeur moisie. Très toxique par inhalation. Légèrement soluble dans l’eau. Corrosif pour les tissus. En cas d’exposition prolongée au feu ou à la chaleur, les conteneurs peuvent se rompre violemment et provoquer une fusée. Utilisé pour fabriquer d’autres produits chimiques et comme composant de carburants pour fusées.,
Air & réactions de L’eau
légèrement soluble dans l’eau.
profil de réactivité
le trifluorure d’azote est un agent oxydant très puissant. Présente un risque d’incendie dangereux en présence d’agents réducteurs. Eaux-fortes de verre en présence d’humidité. Émet des vapeurs toxiques et corrosives de fluorure lorsqu’il est chauffé à la décomposition . Peut réagir violemment avec l’hydrogène, l’ammoniac, le monoxyde de carbone, le diborane, le sulfure d’hydrogène, le méthane, la tétrafluorohydrazine, le charbon de bois. Réaction Explosive avec le dioxyde de chlore., Une forte explosion peut se produire lorsqu’elle est exposée à des agents réducteurs sous pression .
danger
risque d’explosion grave. Corrosif pour les tissus. Méthémoglobinémie, lésions hépatiques et rénales.
danger pour la santé
L’inhalation de trifluorure d’azote peut réduire la capacité des globules rouges à transporter l’oxygène. Cela provoque une cyanose, ou une décoloration bleuâtre de la peau. La respiration du trifluorure d’azote peut également entraîner des maux de tête, des vertiges, de la faiblesse et de la confusion., Après une exposition prolongée à des concentrations élevées, la dégradation des globules rouges et des modifications du foie, des reins, de la rate et du muscle cardiaque peuvent survenir comme effets secondaires. À l’air frais, les changements initiaux des globules rouges s’effaceront pendant plusieurs heures, mais la personne doit toujours être surveillée pour les effets secondaires.
risque D’incendie
la Substance ne brûle pas mais favorise la combustion. Certains peuvent réagir de manière explosive avec les carburants. Peut enflammer des combustibles (bois, papier, Huile, vêtements, etc.). Les vapeurs de gaz liquéfié sont initialement plus lourdes que l’air et se propagent le long du sol., Le ruissellement peut créer un risque d’incendie ou d’explosion. Les conteneurs peuvent exploser lorsqu’ils sont chauffés. Les cylindres rompus peuvent Fuser.
Utilisations industrielles
le trifluorure d’azote a été utilisé avec succès en grandes quantités comme source de fluor pour les lasers chimiques à haute énergie. Il est préféré au fluor en raison de sa facilité de manipulation dans des conditions ambiantes.,
récemment, une quantité croissante de trifluorure d’azote est utilisée dans l’industrie des semi-conducteurs comme agent de gravure à sec, montrant des taux de gravure et des sélectivités significativement plus élevés par rapport au tétrafluorure de carbone et aux mélanges de tétrafluorure de carbone et d’oxygène.
le trifluorure D’azote a également été utilisé comme oxydant dans les fusées au début des années 1960, mais cette application n’a pas été commercialisée.
Matériaux utilise
à des températures inférieures à 250°C (482°F), le trifluorure d’azote a une réactivité similaire à celle de l’oxygène et est relativement inerte à la plupart des matériaux de construction., Aux températures ambiantes, le laiton,l’aluminium, le cuivre, l’acier et les aciers inoxydables peuvent être utilisés car les taux de corrosion sont inférieurs à 0,1 mil/an. à 160 ° F (71,1°C) ont été déterminés pour ces matériaux. Le trifluorure d’azote est égalementcompatible avec des matériaux fluorés tels queflon à température ambiante temperatures.At l’augmentation des températures et des pressions, la réactivité du trifluorure d’azote augmente devenant plus semblable à celle du fluor, le nickel et le monel étant les matériaux de construction préférés.
profil de sécurité
un poison. Légèrement toxique par inhalation., Une absorption prolongée peutprovoquer des marbrures des dents, des changements squelettiques.Risque d’explosion grave par réaction chimique avec des agents réducteurs, en particulier lorsqu’ils sont sous pression. Un incendie très dangereux; un oxydant très puissant; othiseinert à des températures et des pressions normales.
Exposition Potentielle
ce matériau a été utilisé dans la synthèse chimique et comme oxydant pour les carburants à haute énergie (oxydant asan dans les combinaisons de propulseurs de fusée).
effets physiologiques
L’ACGIH recommande une valeur limite moyenne pondérée par le temps (TLV-TWA) de 10 ppm (29 mgim3) pour le trifluorure d’azote., Le LV-TWA est la concentration moyenne pondérée dans le temps pour une journée de travail non normale de 8 heures et une semaine de travail de 40 heures, à laquelle presque tous les travailleurs peuvent être exposés à plusieurs reprises, jour après jour, sans effet indésirable.
L’OSHA indique une limite D’exposition moyenne pondérée dans le temps de 8 heures (TWA-PEL)de 10 ppm (29 mg/m3) pour le trifluorure d’azote.TWA-PEL est la limite d’exposition qui ne doit pas être dépassée par le TWAin de 8 heures n’importe quel quart de travail de 8 heures d’une semaine de travail de 40 heures.,
la toxicité du trifluorure d’azote est liée à sa capacité à fonn méthémoglobine, un fonn modifié de l’hémoglobine incapable de oxygentransport, et à détruire les globules rouges(hémolyse). À l’arrêt de l’exposition, la méthémoglobine revient spontanément à l’hémoglobine. Cependant, à des niveaux d’exposition élevés, une intervention thérapeutique peut être nécessaire (oxygène,bleu de méthylène, transfusion d’échange). L’apparition de l’hémolyse nécessite une surveillance attentive du degré d’anémie et du potentiel d’altération de la fonction rénale.,
la valeur TLV-TWA du trifluorure d’azote de 10ppm résulte d’une étude qui a exposé des rats à 100 ppm pendant 7 heures par jour, 5 jours par semaine pendant 18 mois. Aucun changement n’a été détecté dans les comportements des animaux, les taux cardiaques ou pulmonaires, les niveaux sanguins ou l’apparition de fluorose. ACGIH a fixé le TLV-TWA à III 0 du niveau d’essai.
le trifluorure D’azote gazeux est considéré comme inoffensif pour la peau et comme un irritant mineur pour les yeux et les muqueuses.
stockage
les bouteilles de trifluorure D’azote doivent être solidement supportées pendant l’utilisation pour empêcher le mouvement et la tension des connexions., Les bouteilles pleines doivent être entreposées dans un endroit bien ventilé, à l’abri de la chaleur excessive (125°F ou 51,7°C), à l’écart des matières organiques ou inflammables et sécurisées. Les bouchons de protection et les bouchons de sortie de soupape doivent être solidement en place en tout temps lorsque le cylindre n’est pas utilisé.
expédition
UN2451 trifluorure d’azote, classe de danger: 2.2;étiquettes: 2.2-gaz comprimé ininflammable; 5.1-comburant.Les bouteilles doivent être transportées en position verticale sûre, dans un camion bien ventilé. Protégez le cylindre et les étiquettes des dommages physiques., Le propriétaire de la bouteille de gaz compresséest la seule entité autorisée par la loi fédérale (49cfr) àles transporter et les remplir. C’est une violation du transportrèglements pour remplir les bouteilles de gaz comprimé sans l’autorisation écrite expresse du propriétaire.
évaluation de la toxicité
la toxicité du trifluorure d’azote est liée à sa capacité à faire fondre la méthémoglobine, une fonte modifiée de l’hémoglobine incapable de transporter l’oxygène, et à détruire les globules rouges (hémolyse). À l’arrêt de l’exposition, la méthémoglobine revient spontanément à l’hémoglobine., Cependant, à des niveaux d’exposition élevés, une intervention thérapeutique peut être nécessaire (oxygène, bleu de méthylène, transfusion d’échange). L’apparition de l’hémolyse nécessite une surveillance attentive du degré d’anémie et du potentiel d’altération de la fonction rénale.
Incompatibilités
Le gaz est un oxydant puissant. Présente un risque d’incendie dangereux en présence d’agents réducteurs. Eaux-fortes de verre en présence d’humidité., Réagit avecl’huile, la graisse, les agents réducteurs et autres matériaux oxydables;combustibles, matières organiques, ammoniac,monoxyde de carbone; méthane, hydrogène,sulfure d’hydrogène; charbon actif; diborane, eau. Peut réagir violemment avec l’hydrogène, l’ammoniac, le monoxyde de carbone, le diborane, le sulfure d’hydrogène, le méthane,la tétrafluorohydrazine, le charbon de bois. Le trifluorure d’azote augmentera l’intensité d’un feu existant.
élimination des déchets
retourner les bouteilles de gaz compressées rechargeables au fournisseur., Évacuer dans un grand volume de concentrationagent réducteur (bisulfites, sels ferreux ou hypo)solution, puis neutraliser et rincer à l’égout avec de grandevolumes d’eau.
GRADES disponibles
le trifluorure d’azote est disponible en grades allant de 98% à 99,995% de pureté V / vminimum.
