Serie
\
I valori di \(n_2\) e wavenumber \(\widetilde{\nu}\) per questa serie sarebbe:
Non si sa in quale regione della radiazione elettromagnetica queste linee sono? Naturalmente, queste linee si trovano nella regione UV e non sono visibili, ma vengono rilevate dagli strumenti; queste linee formano una serie Lyman., Le esistenze della serie Lyman e della serie Balmer suggeriscono l’esistenza di più serie. Ad esempio, la serie con \(n_2 = 3\) e \(n_1\) = 4, 5, 6, 7, … si chiama serie Pashen.
Serie multipla
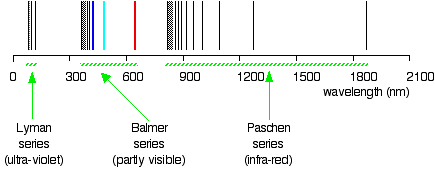
Esempio \(\PageIndex{1}\): La serie Lyman
La cosiddetta serie Lyman di linee nello spettro di emissione dell’idrogeno corrisponde alle transizioni da vari stati eccitati all’orbita n = 1. Calcola la lunghezza d’onda della linea a più bassa energia nella serie Lyman a tre cifre significative. In quale regione dello spettro elettromagnetico si verifica?,
Data: energia più bassa orbita nel Lyman serie
Chiesto: lunghezza d’onda dell’energia più bassa Lyman linea e la corrispondente regione dello spettro
Strategia:
Soluzione:
Possiamo usare l’equazione di Rydberg (Equazione \ref{1.5.1}) calcolare la lunghezza d’onda:
\
Per la serie di Lyman, \(n_1 = 1\).
Gli spettroscopisti spesso parlano di energia e frequenza come equivalenti. L’unità cm-1 (wavenumbers) è particolarmente conveniente. Possiamo convertire la risposta nella parte A in cm-1.,
e
\
Questa linea di emissione è chiamata Lyman alpha ed è la più forte linea di emissione atomica dal sole e guida la chimica dell’atmosfera superiore di tutti i pianeti producendo ioni spogliando elettroni da atomi e molecole. È completamente assorbito dall’ossigeno nella stratosfera superiore, dissociando le molecole di O2 in atomi di O che reagiscono con altre molecole di O2 per formare ozono stratosferico
B Questa lunghezza d’onda si trova nella regione ultravioletta dello spettro.,
Esercizio \(\PageIndex{1}\): La serie Pfund
La serie Pfund di linee nello spettro di emissione dell’idrogeno corrisponde alle transizioni da stati eccitati superiori a \(n_1 = 5\). Calcola la lunghezza d’onda della seconda linea nella serie Pfund a tre cifre significative. In quale regione dello spettro si trova?
Risposta
\(4.65 \volte 10^3\, nm\); infrarosso
La discussione precedente presenta solo una descrizione fenomenologica delle linee di emissione dell’idrogeno e non fornisce una sonda della natura dell’atomo stesso., Chiaramente un modello continuo basato sulla meccanica classica non è applicabile e, come dimostra la Sezione successiva, è possibile formulare una semplice connessione tra spettri e struttura atomica.
