6.3 In che modo l’energia è correlata alla lunghezza d’onda della radiazione?
Possiamo pensare alla radiazione sia come onde che come singole particelle chiamate fotoni. L’energia associata a un singolo fotone è data da E = hv, dove E è l’energia (unità SI di J), h è la costante di Planck (h = 6,626 x 10-34 J s), e ν è la frequenza della radiazione (unità SI di s–1 o Hertz, Hz) (vedi figura sotto)., La frequenza è correlata alla lunghezza d’onda di λ=c/ν , dove c, la velocità della luce, è 2,998 x 108 m s–1. Un’altra quantità che vedrai spesso è il numero d’onda, σ=1 / λ, che viene comunemente riportato in unità di cm–1.
L’energia di un singolo fotone che ha la lunghezza d’onda λ è data da:
E = hc λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., L’energia di una mole di fotoni che hanno la lunghezza d’onda λ si trova moltiplicando l’equazione precedente per il numero di Avogadro:
E m = hc N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
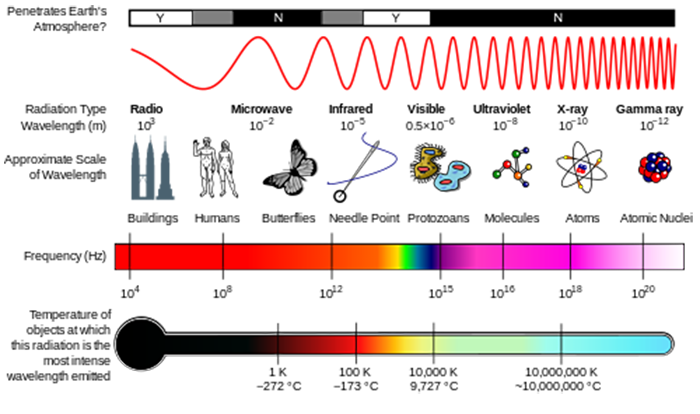
Nella lezione sulla composizione atmosferica, hai visto come la radiazione UV solare è stata in grado di rompere le molecole per avviare la chimica atmosferica. Queste molecole assorbono l’energia di un fotone di radiazione, e se tale energia fotonica è maggiore della forza del legame chimico, la molecola può rompersi.
Controlla la tua comprensione
Considera la reazione O3 + UV → O2 + O*. Se la forza di legame tra O2 e O* (cioè,, atomo di ossigeno stato eccitato) è 386 kJ mol-1, qual è la lunghezza d’onda più lunga che un fotone può avere e ancora rompere questo legame?
RISPOSTA: Risolvere per lunghezza d’onda in equazione
λ= 1.196 × 10 8 J nm mol -1 E m = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
