La D – E L-notazione per la configurazione assoluta di zuccheri e aminoacidi
Che cosa differenzia “D-Glucosio” da “L-Glucosio” ? O D-alanina da L-alanina?
E cos’è questa D-e L-nomenclatura, comunque? Continua a leggere:
Sommario
- D – e L – fornisce una breve scorciatoia per designare gli enantiomeri
- Perché ci preoccupiamo di questa antica nomenclatura?,
- Il sistema L – e D per l’assegnazione di “Configurazione assoluta”
- Quattro – Carbonio aldeide D-e L – Zuccheri (aldotetrosi)
- Cinque-carbonio aldeide D-e L-zuccheri (Aldopentosi)
- Sei-carbonio aldeide D – e L – zuccheri (aldoesosi)
- Ma aspetta – C’è di più! (Aminoacidi)
- Sommario: D – e L-Notazione per zuccheri e aminoacidi
- Note
- (avanzate) Riferimenti e ulteriori letture
D – E L – Fornisce una breve abbreviazione per la designazione enantiomeri
D – e L – notazione fornisce una rapida abbreviazione per la designazione enantiomeri.,
Il D-Glucosio è l’enantiomero del L-Glucosio, per esempio. Come L-alanina è l’enantiomero di D-Alanina.
È assegnato come segue. Per uno zucchero disegnato nella proiezione di Fischer con il carbonio più ossidato nella parte superiore (cioè aldeide o chetone)
- se l’OH sul centro chirale inferiore punta a destra, viene indicato come D-
- se l’OH sul centro chirale inferiore punta a sinistra, viene indicato come L- .
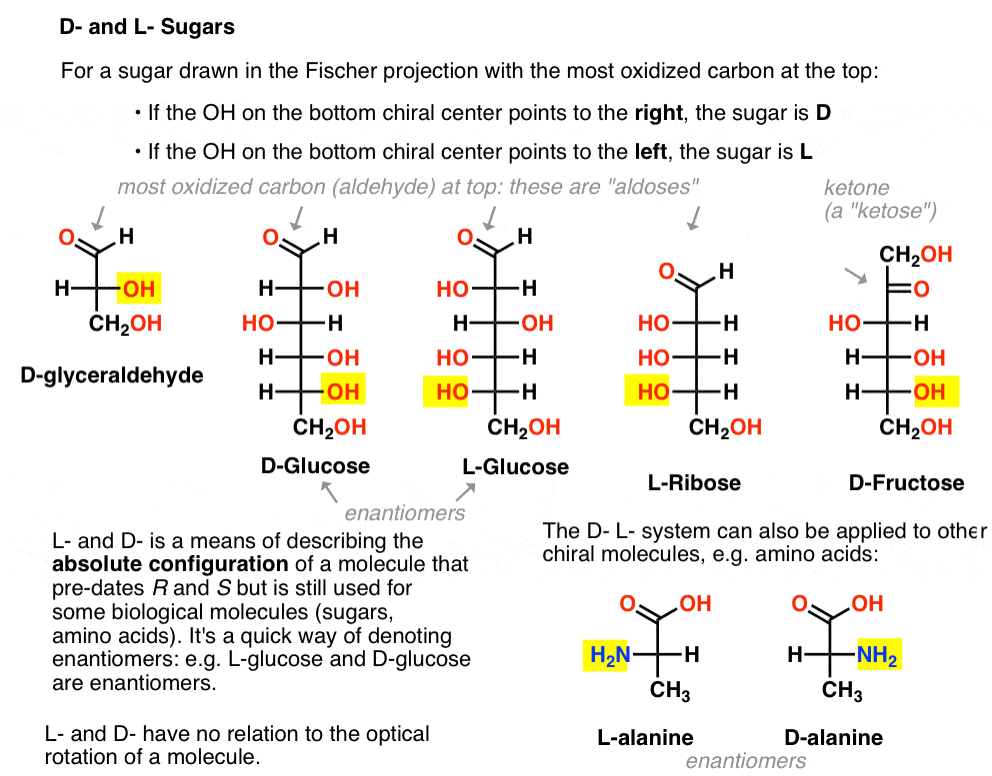
Questa terminologia può essere applicata anche agli amminoacidi: vedi L – e D – alanina nell’immagine sopra.,
2. Perché ci preoccupiamo di questa antica nomenclatura?
Potresti giustamente chiedere: non abbiamo già un sistema per assegnare la configurazione assoluta ? Perché abbiamo bisogno di un nuovo sistema?
Il sistema DL non è un nuovo sistema, gente. È il vecchio sistema-precede Cahn-Ingold-Prelog.
Il sistema D-L è letteralmente un residuo dell’era dei cavalli e dei buggy, risalente al lavoro di Emil Fischer sui carboidrati alla fine del 1800-un tempo in cui i chimici organici non avevano modo di determinare la configurazione assoluta degli stereocentri, che divenne possibile solo nel 1951 (thx, Bijvoet).,
Quindi perché si abitua ancora? Non dovrebbe essere consegnato alla pattumiera della storia, insieme a regoli, cassette a 8 tracce e floppy disk da 5¼”?
Bene, ci sono comunità fiorenti in parti dell’America rurale dove persistono carrozze trainate da cavalli – se sai dove guardare. (Forse un giorno ci saranno comuni in cui le persone usano solo la tecnologia informatica degli anni ’70 e’ 80?)
Allo stesso modo c’è una tasca di chimica organica in cui il sistema D-L trova ancora uso, e questo è specificamente nel regno degli zuccheri e degli amminoacidi.,
Questa non è una rivolta dei chimici Amish contro i mali moderni del sistema CIP, a proposito. Ci sono almeno 3 buone ragioni, nel caso specifico di zuccheri e aminoacidi, per usare L – e D -:
- Brevità. Il D-glucosio è molto più veloce da scrivere e dire di (2R,3S,4R,5R)2,3,4,5,6-pentahydroxyhexanal. Il sistema L – / D-consente la configurazione di una molecola con più centri chirali da riassumere con una singola lettera (più il suo nome comune, ovviamente – grazie a Noel per il promemoria)
- Più brevità., Sembra essere un modo rapido di riferirsi agli enantiomeri. L’enantiomero di L-glucosio è D-glucosio. L’enantiomero di L-triptofano è D-triptofano. E mentre potremmo usare i prefissi ( + ) o ( – ) per differenziare i due enantiomeri del glucosio e di altri zuccheri, il segno della rotazione ottica può variare con solvente, temperatura, concentrazione e altri fattori che lo rendono meno che ideale. Inoltre, L – e D-si riferiscono specificamente alla configurazione assoluta, mentre (come abbiamo notato in precedenza) non esiste una semplice relazione tra il segno della rotazione ottica e la configurazione.,
- Si scopre che la maggior parte degli zuccheri naturali sono D-e la maggior parte degli amminoacidi naturali sono L- . C’è un’enorme quantità di informazioni compresse in quella dichiarazione, e non esiste un sistema concorrente (R/S, +/–) che possa sostituire L – e D – con un singolo carattere. Nota
Si ripete: con zuccheri e aminoacidi, L – e D – possono essere designazioni utili. Per altre molecole, puoi in gran parte dimenticartene.
Quindi cos’è questo sistema D-/L e in che modo questi termini si riferiscono alla struttura?,
Unisciti a me, come abbiamo viaggio attraverso il tempo…
L – E D – Sistema Per l’Assegnazione di “Configurazione Assoluta”
Emil Fischer ha iniziato a studiare i carboidrati alla fine del 1880. Era noto da tempo (via Van ‘ t Hoff) che il carbonio era tetraedrico, ed era anche noto che le molecole contenenti carbonio con quattro diversi sostituenti poteva ruotare il piano della luce polarizzata (es. Pasteur). Ciò che non era noto era la configurazione assoluta di nessuna delle molecole chirali – ciò a cui ci riferiremmo oggi come le loro configurazioni” R “e” S”.,
Il carboidrato più semplice contenente un centro chirale è la gliceraldeide, C3H6O3. La gliceraldeide ha tre carboni; rendendolo un “triosio”. Il carbonio più ossidato nella gliceraldeide è un’aldeide, che lo rende anche un “aldoso”.
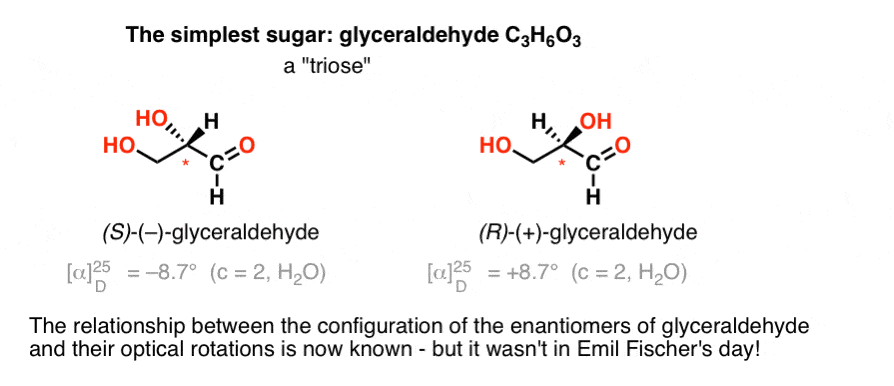
Nel 1888, i due enantiomeri della gliceraldeide erano stati isolati e caratterizzati., Ma poiché non esiste una semplice correlazione tra la configurazione di un centro chirale e la direzione in cui ruota la luce polarizzata piano, Emil Fischer non aveva modo di legare la rotazione ottica di ( + )-e ( – ) –gliceraldeide alla configurazione assoluta degli atomi attorno al centro chirale.
Usando la terminologia di oggi, non aveva modo di sapere se (–)-gliceraldeide fosse (R) o (S).
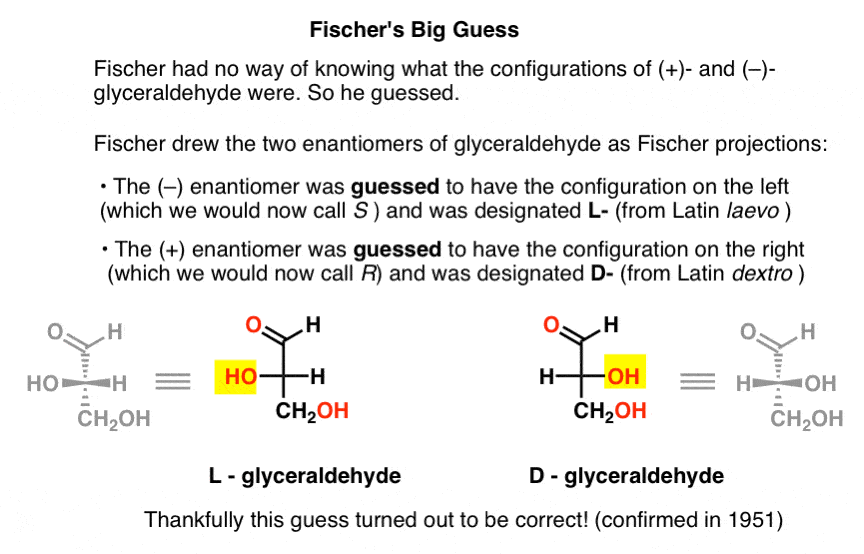
Mancando di questa informazione chiave, Fischer ha scelto di indovinare.,
L’ipotesi, che si è rivelata corretta, era che (–)-gliceraldeide aveva la configurazione che ora chiamiamo S, e che (+)-gliceraldeide ha la configurazione che ora chiamiamo R.
Naturalmente, Cahn, Ingold e Prelog non erano ancora nati, e il sistema CIP sarebbe stato sviluppato solo dopo il lavoro di Bijvoet nel 1951. Così Fischer ha sviluppato la sua nomenclatura.
Disegnando la gliceraldeide in quella che in seguito sarebbe stata chiamata la proiezione di Fischer, assegnò la configurazione a sinistra a (–)-gliceraldeide e la chiamò L- (abbreviazione del latino laevo )., Quindi assegnò la configurazione a destra a ( + )- gliceraldeide e la chiamò D – (per dextro latino ).
Perché è così importante?
Assegnare la configurazione assoluta per L – e D – gliceraldeide era un po ‘ come assegnare il Meridiano Primo (0° longitudine) al Royal Observatory di Greenwich, in Inghilterra., Proprio come la longitudine di ogni altro luogo sulla terra potrebbe quindi essere determinata rispetto a quel punto se le loro distanze relative fossero note, la configurazione assoluta di ogni altro stereocentro potrebbe quindi essere determinata se la sua configurazione relativa alla L – o D – gliceraldeide fosse nota.
Questa potrebbe non essere l’analogia più chiara. Quindi diamo un’occhiata agli zuccheri 4-carbonio per un altro esempio.,
Quattro aldeide di carbonio D – e L – Zuccheri (Aldotetroses)
Una volta che sono state proposte le configurazioni assolute di L – e D – gliceraldeide, le configurazioni assolute di altri composti chirali potrebbero quindi essere stabilite per analogia (e un sacco di lavoro chimico grunt).
Non è cruciale per oggi, ma per un esempio di questo tipo di ragionamento, vedi questo .
Quando è stato introdotto il concetto di centri chirali, probabilmente hai imparato che una molecola con n centri chirali avrà 2n stereoisomeri (purché non ci siano composti meso).,
Ci sono due aldosi a quattro atomi di carbonio, threose ed erythrose. Ognuno di essi ha due centri chirali. Ciascuno esiste come una coppia di enantiomeri (L – e D- ) dando quattro stereoisomeri in totale.
Eccoli. La cosa importante da notare nella figura seguente è che la famiglia L di zuccheri ha il gruppo OH del carbonio chirale inferiore a sinistra, e la famiglia D ha il gruppo OH del carbonio chirale inferiore a destra (evidenziato).,
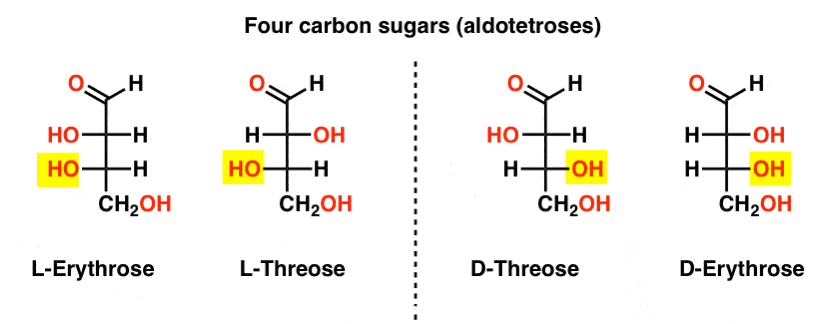
Vedere come L-Eritrosio e L-Threose costruiscono sullo stereocentro stabilito in L-gliceraldeide (evidenziato), e D-Eritrosio e D-Threose costruiscono sullo stereocentro stabilito in D-gliceraldeide (evidenziato).
Zuccheri sono costruiti un po ‘ come il sistema binario; si può pensare di ogni stereocenter è un “bit” che può avere uno dei due valori. La configurazione di L-erythrose e L-threose differisce solo in uno stereocenter. Se dovessimo capovolgere la posizione di H e OH, avremmo l’altro., Questa relazione ha un nome che potresti vedere a volte: due molecole che hanno la configurazione opposta a un solo stereocenter sono chiamate epimeri, in particolare quando uno degli atomi collegati allo stereocenter è un idrogeno (H).
Cinque aldeide di carbonio D – e L – Zuccheri (Aldopentosi)
Il nome più familiare in quella lista dovrebbe essere ribosio, che è la spina dorsale dello zucchero dell’acido ribonucleico (RNA).
Sul lato sinistro nel diagramma sottostante, abbiamo le L-aldopentosi, che condividono tutte la stessa configurazione dello stereocentro inferiore quando l’aldeide è posta in alto.,
I loro enantiomeri, le D-aldopentosi, sono sul lato destro, che condividono tutti la stessa configurazione dello stereocenter inferiore (evidenziato).
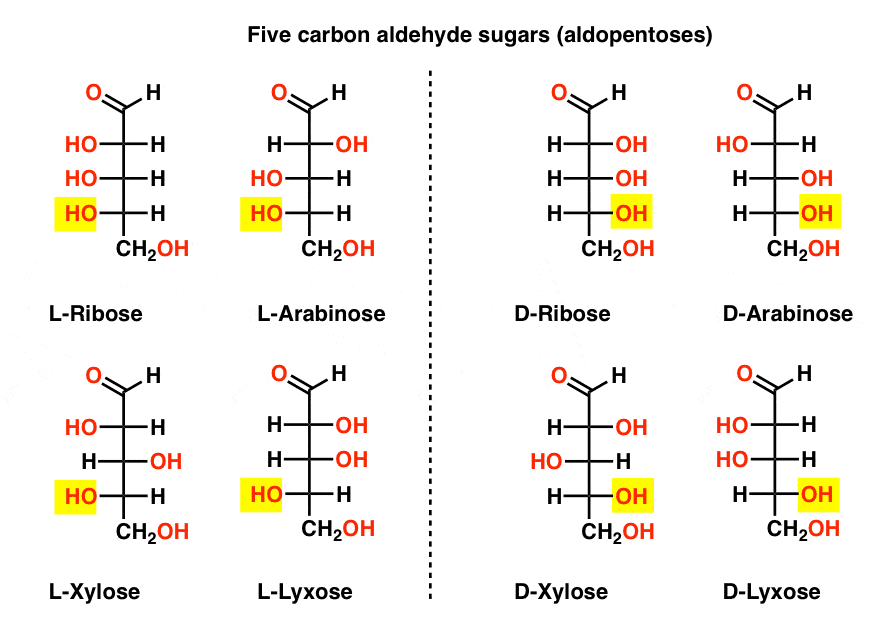
A questo punto dovremmo sottolineare che la stragrande maggioranza degli zuccheri nelle forme di vita terrestri sono D-zuccheri, incluso il D – ribosio come spina dorsale dell’RNA. Perché e come tutti gli organismi sulla terra sono finiti con D-zuccheri è un mistero, come si presume che L-zuccheri avrebbero funzionato altrettanto bene.,
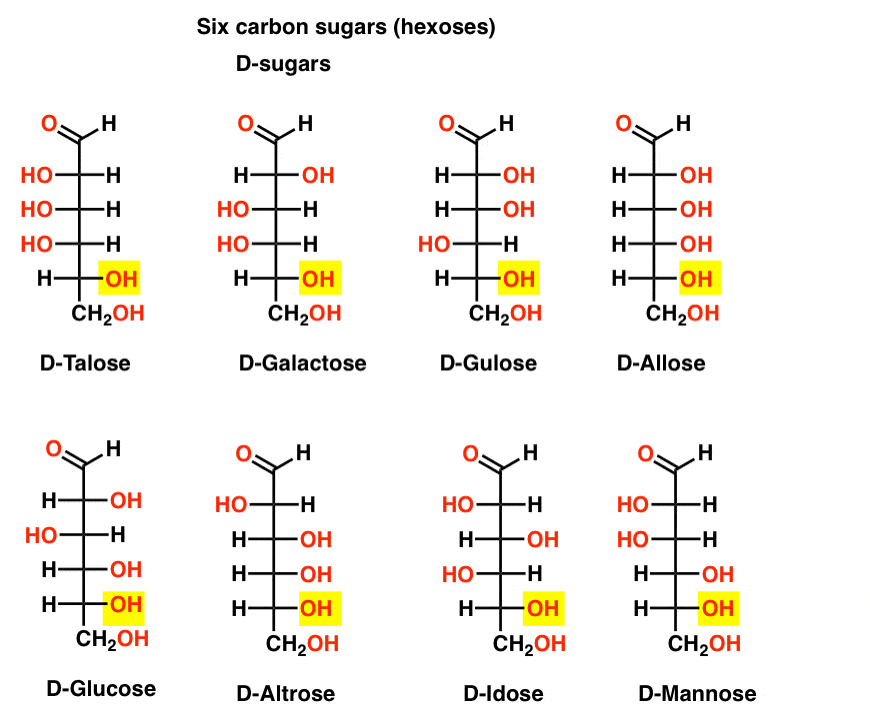
Sei aldeide di carbonio D – e L – Zuccheri (Aldoesosi)
Se ci sono 4 aldopentosi, ciascuna come coppia D – L di enantiomeri (8 stereoisomeri totali)allora quante aldoesosi ci sono?
Ci sono 8 coppie D-L (16 stereoisomeri totali). Il più familiare è il glucosio, ma probabilmente riconoscerai mannosio e galattosio. Alcuni sono raramente, se mai, trovati in natura (idose, chiunque?).
Ecco le D-aldoesosi. Nota come tutti hanno la stessa configurazione del centro chirale inferiore-lo stesso che abbiamo visto nella D-gliceraldeide.,
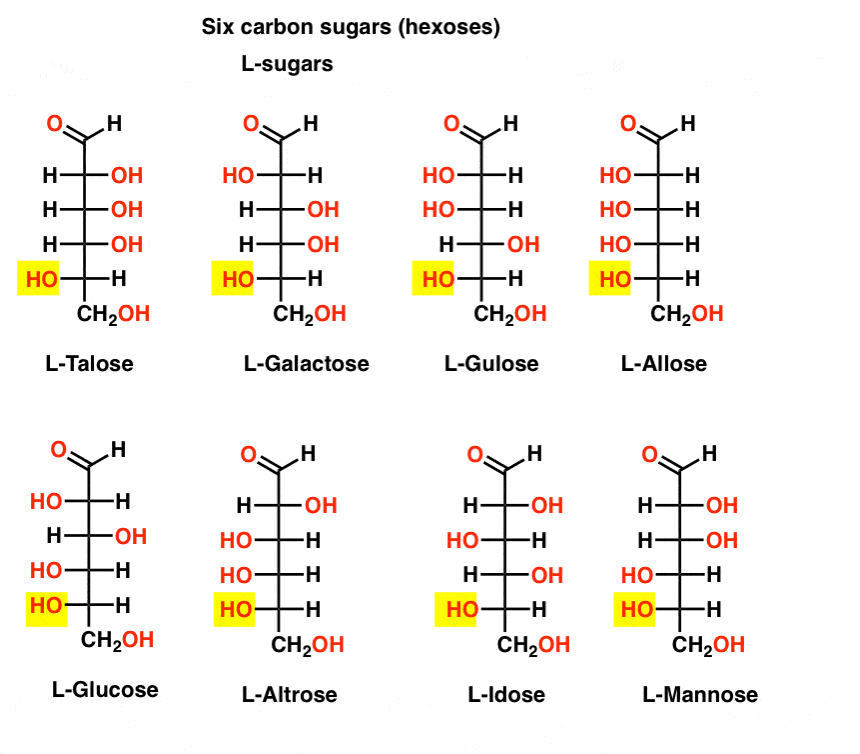
In contrasto con gli zuccheri D, gli zuccheri L (sotto) si trovano raramente in natura. È interessante notare che L-glucosio è stato esplorato come sostituto dello zucchero. Il suo gusto è indistinguibile dal D-glucosio naturale, ma non fornisce nutrimento poiché non può essere scomposto dai nostri enzimi (chirali). Come risulta la produzione è semplicemente troppo costoso per competere con splenda, stevia, aspartame et. al.
OK, basta così. Sono stati prodotti zuccheri a sette atomi di carbonio (aldoeptosi) ma non sono biologicamente significativi.,
7. Ma aspetta-C’è di più! (Aminoacidi)
Se si disegnano aminoacidi nella proiezione di Fischer con il gruppo più ossidato nella parte superiore (l’acido carbossilico), è anche possibile assegnare L – e D-.
Dei 19 amminoacidi chirali che sono incorporati nelle proteine (proteinogenic è il termine corretto) sono tutti L- . (La glicina è achirale, quindi D – e L-non si applica). Alcuni D-amminoacidi sono presenti in natura, ma sono rari (si trovano principalmente nei batteri, con la notevole eccezione del veleno dell’ornitorinco) e non sono codificati dall’mRNA.,
È interessante notare che, sebbene tutti i 19 aminoacidi chirali siano L- , solo 18 dei 19 sono (S). Qual è l’eccezione?
(Questa è una buona barra di chimica organica).
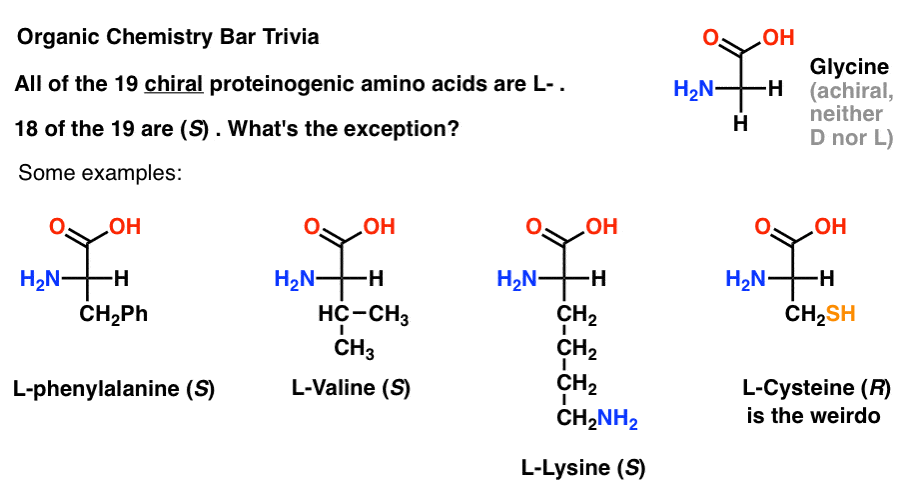
La cisteina è la più strana.
(Punti bonus se hai anche detto selenocysteine ner nerd).
Sommario: D – e L – Notazione per zuccheri e aminoacidi
Quindi questo è il sistema D – L per l’assegnazione della configurazione assoluta. Funziona bene per gli zuccheri poiché possono essere costruiti in modo sistematico (come il sistema binario). È anche utile per gli aminoacidi., Il punto chiave è solo guardare lo stereocenter inferiore mentre è disegnato nella proiezione di Fischer. Giusto? D. Sinistra? L.
Naturalmente, gli zuccheri non sono sempre così utilmente disegnati nelle proiezioni di Fischer – formano anelli. Scriveremo sulla determinazione di D – e L-negli zuccheri ciclici in un post futuro.
Tutto quello che ho da dire è, grazie a qualsiasi divinità tu scelga di credere che l’ipotesi di Fischer si sia rivelata corretta. Sarebbe un enorme dolore nel culo per setacciare 70 + anni della letteratura chimica sapendo che la configurazione sbagliata era stata assegnata a tutti gli zuccheri e aminoacidi.,
Grazie a Thomas Struble per l’assistenza con questo post.
Note
Nota 1. “il penultimo stereocentro nella maggior parte degli zuccheri chirali è R, mentre lo stereocentro nella maggior parte degli amminoacidi è S” non ha lo stesso anello, soprattutto perché la cisteina è R. ]
Nota. Ecco un esperimento mentale per determinare le configurazioni relative di erythrose e threose., (Dico “esperimento mentale” perché non voglio includere reagenti specifici, che potrebbero distrarre)
Se si inizia con puro (+)-eritrosio e si ossida l’alcol primario in un’aldeide usando metodi noti, si ottiene un composto privo di rotazione ottica. Lo stesso vale per (–)-eritrosio, che restituisce un composto completamente identico. Da ciò si può dedurre che la struttura del nuovo composto deve essere tale che la molecola abbia un piano specchio interno (cioè è meso). .,
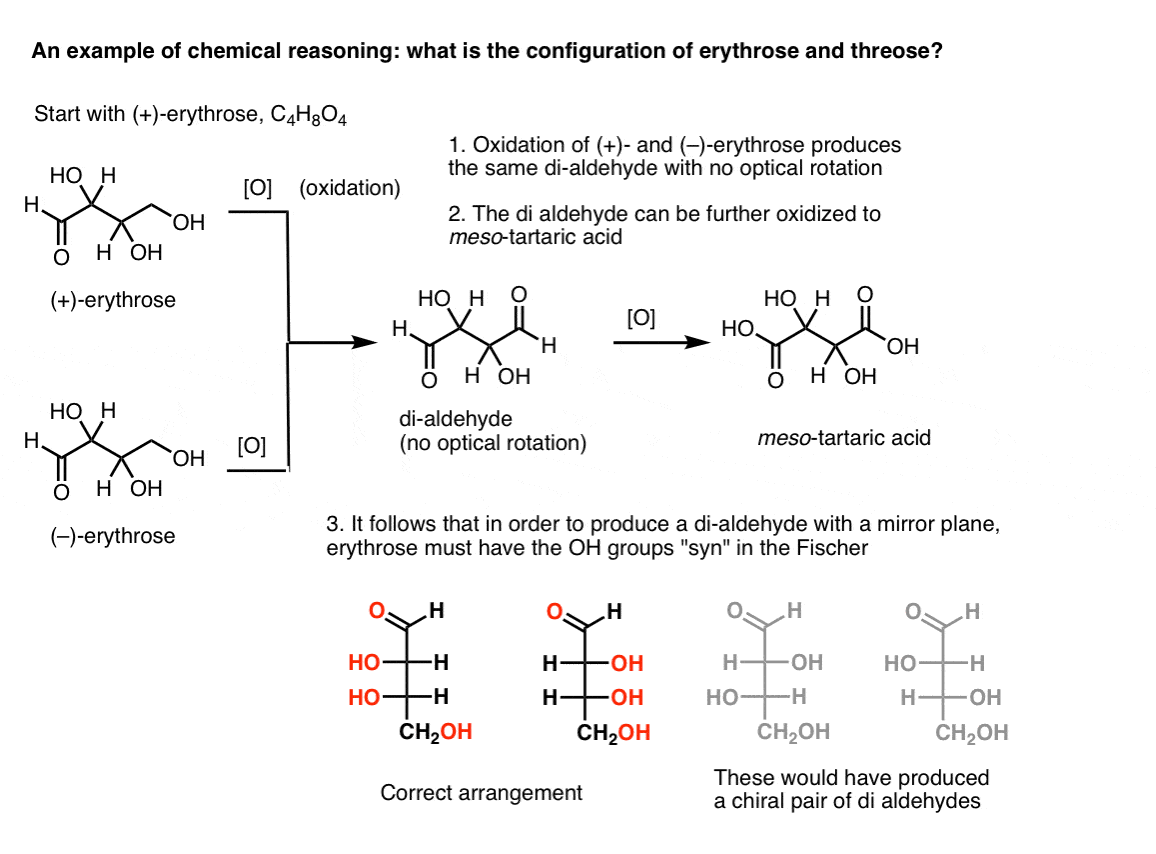
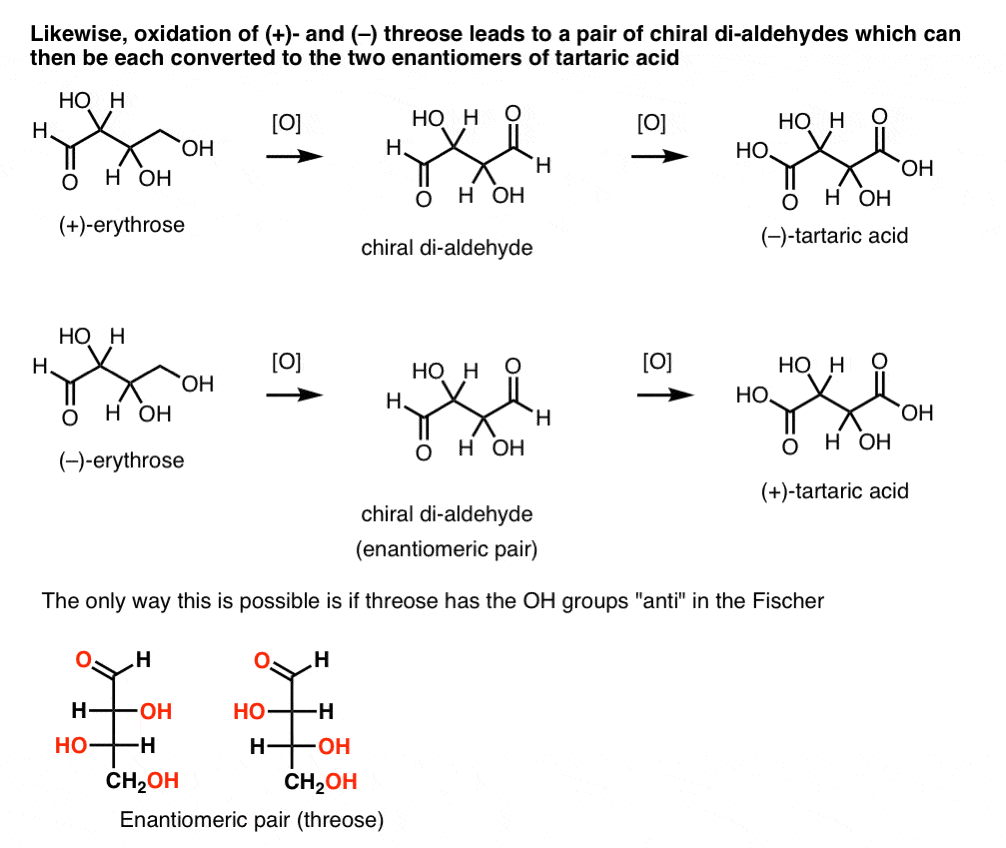
Al contrario, eseguendo la stessa operazione su (+)-threose si ottiene una di-aldeide che mantiene la rotazione ottica. Un composto con rotazione ottica uguale e opposta si forma eseguendo la stessa operazione su (- ) – threose. Questi due composti sono enantiomeri. Affinché ciò sia vero, l’orientamento relativo dei gruppi idrossilici in threose deve essere anti. Questi composti possono essere ossidati ulteriormente per produrre, rispettivamente, ( – ) – e (+)- acido tartarico.,
Lo stesso ragionamento può essere usato nella direzione opposta (riduzione). Per esempio ( + )-o ( – ) – eritrosio può essere ridotto al tetra-eryth eritritolo, che è meso.
Allo stesso modo, la riduzione di (+)- e (–) threose si traduce in una coppia enantiomerica di tetra-ols, threitol.
Da questi fatti possiamo dedurre l’orientamento relativo dei gruppi OH.
(Avanzato) Riferimenti e approfondimenti
- Über die Bezeichnung von optischen Antipoden durch die Buchstaben d und l
Emil Fischer
Ber. 1907, 40 (1), 102-106
DOI: 10.,1002 / cber.19070400111
Questo è il famoso documento in cui il Prof. Emil Fischer (arbitrariamente!) assegnato ( – ) – gliceraldeide L-stereochimica. - Sintesi nel gruppo delle purine e dello zucchero
Emil Fischer
Nobel Lecture, 1902Fischer’s Nobel Lecture, dove parla del suo lavoro non solo nei carboidrati, ma anche nelle purine, di cui sono membri composti come la caffeina e la teobromina. Il Prof. Fisher prevede l’aumento delle bevande energetiche (ad es., Red Bull), affermando, “con l’esercizio di un po’ di immaginazione si può prevedere il giorno in cui i fagioli non saranno più necessari per fare un buon caffè: una piccola quantità di polvere da una sostanza chimica funziona insieme all’acqua fornirà una bevanda salata e rinfrescante sorprendentemente a buon mercato”.
- Determinazione della configurazione assoluta dei composti otticamente attivi mediante raggi X
BIJVOET, J., PEERDEMAN, A. & van BOMMEL, A.,
Nature 1951, 168, 271-272
DOI: 1038/168271a0
La famosa carta che ha dimostrato, utilizzando l’analisi strutturale a raggi X, che “Convenzione di Emil Fischer, che ha assegnato la configurazione di Fig. 2 all’acido destrorotatorio, sembra rispondere alla realtà”. - La scoperta di Emil Fischer della configurazione del glucosio. Una retrospettiva semicentenaria
CS Hudson
Journal of Chemical Education 1941, 18 (8), 353
DOI: 10.1021/ed018p353
Una prima revisione che copre il lavoro del Prof. Emil Fischer nella chimica dei carboidrati., - La prova di Emil Fischer della configurazione degli zuccheri: un tributo centenario
Frieder W. Lichtenthaler
Angew. Chimica. Int. Ed. 1992, 31 (12), 1541-1556
DOI: 10.1002/anie.199215413
Una recensione molto leggibile da 1992 che copre il lavoro del Prof. Fischer nella chimica dei carboidrati e approfondisce le assegnazioni stereochimiche dei carboidrati.
