Introduzione
Le infezioni nosocomiali causate da Acinetobacter baumannii multiresistente stanno diventando sempre più comuni in tutto il mondo, specialmente in ambito di terapia intensiva (Wieland et al., 2018). Il successo di questo batterio è facilitato dalla sua capacità di sopravvivere in una varietà di ambienti aggravata dalla sua rapida capacità di acquisire resistenza multidrug. I carboidrati di superficie giocano un ruolo chiave nella forma fisica e nella virulenza generali di A., baumannii (Lees-Miller et al., 2013; Geisinger e Isberg, 2015; Weber et al., 2016). A. baumannii produce polisaccaride capsulare ad alto peso molecolare (CPS) che circonda la membrana esterna (Figura 1) (Russo et al., 2010). Composto da subunità ripetute di oligosaccaridi (unità K) strettamente imballate, il CPS forma uno strato discreto sulla superficie batterica fornendo protezione da diverse condizioni ambientali, assistendo all’evasione delle difese immunitarie dell’ospite e aumentando la resistenza a un certo numero di composti antimicrobici (Russo et al., 2010; Iwashkiw et al., 2012; Geisinger e Isberg, 2015).,
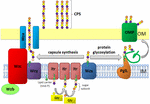
Figura 1. Rappresentazione schematica dell’assemblaggio e dell’esportazione del polisaccaride della capsula in A. baumannii. La sintesi inizia con la transferasi iniziale (Itr; marrone) situata nella membrana interna (IM) trasferendo il primo zucchero dell’unità ripetuta a un vettore lipidico (Und-P; cerchio verde). Gli zuccheri successivi vengono quindi aggiunti all’unità di crescita da specifiche glicosiltransferasi (Gtr; giallo) sul lato citosolico della membrana interna., La subunità della capsula (unità K) viene quindi trasferita al periplasma tramite la proteina di membrana integrale Wzx (blu scuro). Le subunità di zucchero sono polimerizzate dalla proteina Wzy (viola) e il complesso Wza/Wzb/Wzc (ciano, calce, rosso) coordina la polimerizzazione ad alto livello e l’esportazione della catena di crescita, spostandole sulla membrana esterna (OM). Per la glicosilazione, PglL (arancione) collega le unità K su proteine di membrana esterne selezionate (OMP; verde scuro).
In A. baumannii, l’assemblaggio e l’esportazione della capsula avvengono tramite un percorso dipendente da Wzy (Hu et al., Nel 2013, Kenyon e Hall, 2013, Willis e Whitfield, 2013, Woodward e Naismith, 2016) (Figura 1). Tipicamente costituito da 4-6 zuccheri, l’unità K è assemblata sulla molecola portante lipidica undecaprenyl pirofosfato (Und-P) che fornisce un’impalcatura per la catena di zucchero in crescita (Whitfield, 2006). Il primo zucchero nell’unità K viene reclutato da una transferasi iniziale legata alla membrana interna (IM) (Itr), seguita dall’aggiunta sequenziale di zuccheri all’unità K crescente da enzimi specifici della glicosil transferasi (Gtr) (Figura 1) (Woodward e Naismith, 2016)., Ogni unità K viene quindi trasferita al lato periplasmico dell’IM dalla traslocasi Wzx e polimerizzata da Wzy, che trasferisce la crescente catena di polisaccaridi da un vettore Und-P alla successiva subunità in entrata (Figura 1) (Collins et al., 2007). Dopo che il polimero CPS è stato sintetizzato, viene trasportato sulla superficie cellulare attraverso un processo altamente coordinato che coinvolge l’interazione di tre proteine; Wza, Wzb e Wzc, che costituiscono il macchinario di esportazione (Figura 1)., La sintesi di CPS rappresenta un braccio di una via biforcata, poichè queste unità di K egualmente sono usate per decorare determinate proteine di superficie via la glicosilazione O-collegata della proteina (Lees-Miller et al., 2013). In questo caso, le singole unità K vengono trasferite alle proteine riceventi dall’O-oligosaccariltransferasi PglL (Figura 1) (Iwashkiw et al., 2012). In A. baumannii, la glicosilazione proteica contribuisce alla formazione del biofilm migliorando l’attaccamento iniziale e la maturazione dei biofilm e la patogenicità come dimostrato in un certo numero di modelli di infezione animale (Iwashkiw et al., 2012; Scott et al., 2014; Harding et al.,, 2015). Il biofilm è uno stato di crescita in cui le comunità batteriche sono racchiuse all’interno di una matrice di esopolisaccaridi e ha dimostrato di svolgere un ruolo significativo nella persistenza e nella resistenza di A. baumannii.
Altri carboidrati di superficie noti per influenzare la patogenicità di A. baumannii includono il lipooligosaccaride (LOS) e l’esopolisaccaride poli-β-(1-6)-N-acetilglucosamina (PNAG) (Preston et al., 1996; Weber et al., 2016). PNAG forma la “colla” coesiva dei biofilm e costituisce una percentuale sostanziale di biofilm (Choi et al., 2009; Longo et al., 2014)., A differenza della maggior parte dei batteri Gram-negativi, A. baumannii non produce lipopolisaccaride tradizionale, ma invece un glicosin-coniugato di superficie simile, LOS, costituito da un nucleo lipidico A privo di antigene O (Kenyon e Hall, 2013; Kenyon et al., 2014b). La perdita di produzione di LOS in A. baumannii diminuisce la stabilità della membrana esterna che porta a una ridotta forma fisica (Moffatt et al., 2010; Beceiro et al., 2014).
Sebbene molte porzioni di carboidrati influenzino la patogenicità, si può sostenere che la CPS è un fattore di virulenza predominante di A. baumannii. Questa recensione mira a consolidare ciò che è noto su A., capsula di baumannii comprendente strutture selezionate, biosintesi e organizzazione genica, il ruolo della CPS nella virulenza e il potenziale per la CPS come obiettivo per il futuro sviluppo di vaccini e farmaci.
Organizzazione genetica di K Loci
Man mano che i genomi completi di più isolati di A. baumannii diventano disponibili, la vera diversità delle strutture delle capsule presenti all’interno di questo batterio sta diventando evidente. Ad oggi, oltre 100 loci capsula unica (KL) sono stati identificati in A. baumannii (Figura 2A) (Shashkov et al., 2017). Queste regioni in genere vanno da 20 a 35 kb di dimensione., L’analisi dei geni che dirigono la sintesi CPS in dieci genomi completi di A. baumannii ha originariamente portato alla designazione di nove tipi di capsule, KL1-KL9, che è diventata la base per uno schema di tipizzazione universale per questi loci (Kenyon e Hall, 2013). Questo schema è stato successivamente ampliato per accogliere l’identificazione di nuovi loci K. La posizione cromosomica del locus K, tra i geni fkpA e lldP, è altamente conservata tra i ceppi di A. baumannii e contiene quei geni necessari per la biosintesi e l’esportazione specifici per ciascun tipo di CPS (Figura 2) (Hu et al.,, 2013; Kenyon e Sala, 2013). Un’eccezione a questa regola sono i ceppi di A. baumannii che possiedono regioni KL19 e KL39, dove il gene che codifica la polimerasi Wzy, wzy, si trova su una piccola isola genetica altrove sul cromosoma (Kenyon et al., 2016a). Inoltre, i geni necessari per alcuni degli zuccheri comuni osservati in CPS si trovano altrove., Tutti i loci K mostrano una configurazione genetica simile, un gruppo altamente variabile di geni di sintesi e transferasi necessari per la biosintesi di zuccheri complessi unici di tipo KL, affiancati da un lato dai geni di esportazione CPS altamente conservati e dall’altro da un insieme di geni che codificano zuccheri semplici e precursori conservati (Figura 2A)., I geni wzx e wzy necessari per l’elaborazione di unità di ripetizione sono altamente variabili tra i loci K (Figura 2A, azzurro), indicando la specificità per particolari strutture di unità K e, in generale, l’ordine dei determinanti gtr, che codificano specifiche glicosiltransferasi all’interno delle regioni KL, corrisponde inversamente all’ordine di azione.
La regione variabile di alcuni cluster di geni KL, come KL37 e KL14, mancano di geni per la sintesi complessa dello zucchero, in quanto contengono solo zuccheri semplici nelle loro unità K (Arbatsky et al., 2015; Kenyon et al.,, 2015). Aggiungendo anche alla loro diversità, diverse regioni KL contengono geni ridondanti che non sono necessari per la sintesi dell’unità K finale. Ad esempio KL8 e KL9 contengono due geni itr (Kenyon e Hall, 2013) e KL37 ha la fosfogliceroltransferasi pgt1, ma nessun residuo di fosfoglicerolo corrispondente nella struttura determinata (Arbatsky et al., 2015). Inoltre, in KL93, due elementi di sequenza di inserimento (ISAba26 e ISAba22) interrompono il determinante pgt1 (Figura 2) (Kasimova et al., 2017)., I geni necessari per la biosintesi specifica dello zucchero non saranno discussi in quanto questi percorsi sono stati coperti in precedenza e vanno oltre lo scopo di questa recensione (Hu et al., 2013; Kenyon e Sala, 2013). Inoltre, altri geni situati all’interno del KL codificano i prodotti che si prevede siano coinvolti nella modificazione dell’acetilazione o dell’acilazione di glicani specifici (Figura 2A, rosa). Sebbene l’esame dei loci K possa rivelare molto sulle strutture dell’unità K, sono necessarie analisi chimiche e test biochimici per determinare strutture esatte e identificare collegamenti specifici tra zuccheri ripetuti.,
Strutture CPS
I primi studi sulla sierotipizzazione CPS di A. baumannii sono stati guidati dalla necessità di sviluppare un metodo per discriminare gli isolati di A. baumannii da altre specie di Acinetobacter, poiché l’analisi fenotipica era gravata da ambiguità e errata identificazione (Traub, 1989). Come descritto sopra, c’è una diversità fenomenale vista nei cluster di geni di biosintesi CPS di A. baumannii, che si traduce nella diversità vista nella struttura dell’unità K (Hu et al., 2013; Kenyon e Sala, 2013). Collettivamente, al di sopra di 40 diversi A., le strutture dell’unità baumannii K sono state chiarite finora utilizzando la spettroscopia NMR e l’analisi chimica. Le strutture dell’unità K differiscono nella composizione dello zucchero. Possono includere derivati di zuccheri comuni legati all’UDP come glucosio, galattosio e acido glucuronico o zuccheri rari e atipici come gli acidi non-2-ulosonici. Le strutture variano in lunghezza e possono essere costituite da due soli residui, come si è visto per K53 tipo CPS (Shashkov et al., 2018), o fino a cinque o sei monosaccaridi, come quello visto in K37 (Figura 2B) (Arbatsky et al., 2015)., Le strutture differiscono anche nei collegamenti sia all’interno che tra le unità K con conseguente produzione di unità K che sono lineari o coinvolgono rami laterali, come visto in K1 e K93, rispettivamente (Figura 2B) (Kenyon et al., 2016a; Kasimova et al., 2017). Le differenze nella posizione di specifici legami glicosidici e modelli di O-acetilazione di vari oligosaccaridi all’interno di una struttura contribuiscono anche alla diversità dell’unità K.,
La variazione tra le strutture dell’unità K può essere sottile, ad esempio, K12 e K13 differiscono solo dal legame di due glicani, che richiede l’uso di una polimerasi Wzy alternativa; di conseguenza, i loci K di entrambi i ceppi sono identici tranne che per il gene wzy (Figura 2). In alternativa la variazione può essere sorprendente, come l’incorporazione di zuccheri rari tra cui pseudaminic, legionaminic, o derivati dell’acido acinetaminic come visto in K2/6, K49, e K12/13 strutture, rispettivamente (Figura 2) (Kenyon et al., 2014a, 2015; Vinogradov et al., 2014; Kasimova et al., 2018)., È interessante notare che i derivati dell’acido acinetaminico sono stati identificati solo in A. baumannii e non si trovano in nessun altro luogo in natura (Kenyon et al., 2017). Inoltre, alcune unità K incorporano derivati unici di glicani specifici, ad esempio l’acido pseudaminico di K93 è acetilato con un gruppo (R)-3-idrossibutanoil (Kasimova et al., 2017), mentre in K2 e K6 l’acido pseudaminico non è acetilato (Figura 2)., Inoltre, la struttura di K4 è unica in quanto contiene solo aminosugars, D-QuipNAc e un ramo terminale di N-acetil-D-galattosamina (D-GalpNAcA) che è ricoperto da un gruppo piruvilico, un motivo raro e il primo ad essere descritto in Acinetobacter (Figura 2A, nero) (Kenyon et al., 2016b). Con l’aumentare del numero di strutture di unità K chiarite, aumenta anche la fiducia per dedurre la struttura di unità K dall’analisi dei cluster di biosintesi posizionati nel KL di A. baumannii., Tuttavia, anche se informativo, una comprensione del ruolo CPS gioca nella patogenesi è importante applicare questa conoscenza per migliorare i risultati delle infezioni A. baumannii.
Ruolo nella virulenza, nella resistenza antimicrobica e nella persistenza
È fuori dubbio che la presenza di CPS sia essenziale per la patogenicità di A. baumannii. Non solo è necessario per l’evasione delle difese immunitarie dell’ospite (Russo et al., 2010; Geisinger e Isberg, 2015), ma è importante per la resistenza ai composti antimicrobici e la sopravvivenza in ambienti avversi (Luke et al., 2010; Russo et al.,, 2010; Geisinger e Isberg, 2015). Il CPS media l’evasione immunitaria in molti ceppi di A. baumannii limitando le interazioni tra le strutture superficiali immunogeniche dei batteri e le difese dell’ospite (Preston et al., 1996; Wu et al., 2009; Russo et al., 2010; Umland et al., 2012; Lees-Miller et al., 2013; Geisinger e Isberg, 2015; Wang-Lin et al., 2017). L’abolizione della capsula in diversi ceppi di A. baumannii ha mostrato una ridotta sopravvivenza nel siero umano e nel liquido di ascite e un’attenuazione nei modelli di infezione murina e del ratto (Russo et al., 2010; Umland et al., 2012; Lees-Miller et al.,, 2013; Sanchez-Larrayoz et al., 2017). Inoltre, l’up-regulation della produzione di capsule nel ceppo A. baumannii comunemente utilizzato ATCC 17978 (tipo K3 CPS) ha aumentato la resistenza al siero e la virulenza in un modello di infezione del topo (Geisinger e Isberg, 2015). Inoltre, nuovi trattamenti antimicrobici potrebbero essere sviluppati per specifici tipi di CPS, ad esempio quelli contenenti acido pseudaminico, poiché la sua presenza è stata correlata con una maggiore virulenza (Hitchen et al., 2010; Kao et al., 2016).
Oltre alla protezione dalle difese dell’host, in A., la produzione di baumannii CPS aumenta la resistenza a una gamma di composti antimicrobici, compresi quelli utilizzati per la disinfezione in ambienti clinici (Geisinger e Isberg, 2015; Tipton et al., 2015; Chen et al., 2017). Inoltre, la crescita di A. baumannii nei livelli sub-inibitori degli antimicrobici influenza la produzione di CPS. Ad esempio, l’esposizione agli antibiotici cloramfenicolo o eritromicina ha portato a una maggiore sintesi della capsula in ATCC 17978 (Geisinger e Isberg, 2015) e l’esposizione a meropenem selezionata per mutazioni che portano a una perdita nella produzione di CPS nell’isolato 37662 (Chen et al., 2017)., Gli studi condotti su una gamma più ampia di ceppi di A. baumannii sono necessari per identificare se la protezione contro gli antimicrobici offerta da CPS è specifica del ceppo, specifica del tipo a capsula o universale.
La capacità di A. baumannii di persistere nell’ambiente clinico ha indubbiamente migliorato la colonizzazione e le infezioni nei pazienti sensibili. A. baumannii è in grado di sopravvivere per mesi su superfici ospedaliere come corrimano, mobili e dispositivi medici, fornendo un serbatoio che è spesso fonte di trasmissione e infezione (Wendt et al., 1997; Gayoso et al., 2013)., Si pensa che la notevole tolleranza all’essiccamento di A. baumannii sia dovuta a una strategia di “busto o boom”, in cui una sottopopolazione persistente di cellule sopravvive a spese delle cellule morenti; Il CPS migliora la tolleranza all’essiccamento fornendo una barriera fisica che facilita la ritenzione idrica (Roberts, 1996; Webster et al., 2000; Gayoso et al., 2013; Bravo et al., 2016). Un ruolo diretto per CPS nella resistenza all’essiccamento è stato recentemente dimostrato nel ceppo A. baumannii AB5075 (tipo CPS K25). In questo studio, la variante acapsulare di AB5075 ha mostrato un 2.,riduzione di 5 volte della vitalità rispetto al ceppo parentale (Tipton et al., 2018). Inoltre, in due parenti stretti di A. baumannii, Acinetobacter calcoaceticus e Acinetobacter baylyi, la produzione di esopolisaccaridi e / o CPS ha dimostrato di promuovere la sopravvivenza all’essiccamento (Roberson e Firestone, 1992; Ophir e Gutnick, 1994). Oltre a influenzare la resistenza all’essiccamento, la CPS è stata associata ad altri tratti di virulenza, tra cui la motilità (McQueary et al., 2012; Huang et al., 2014) e la produzione di biofilm (Umland et al., 2012; Lees-Miller et al.,, 2013), cementando così il suo ruolo di fattore patogeno.
Recenti studi hanno collegato il fenotipo variabile di fase di A. baumannii AB5075 con alterazioni nella produzione di CPS, poiché varianti opache altamente virulente producono uno strato di CPS con il doppio dello spessore delle loro controparti traslucide (Chin et al., 2018). Questa transizione da traslucido ad opaco inoltre ha aumentato drammaticamente il potenziale patogeno di A. baumannii AB5075. Anche la resistenza ai comuni disinfettanti ospedalieri e ad un sottoinsieme di antibiotici aminoglicosidici è stata aumentata (Tipton et al., 2015; Chin et al.,, 2018) e le varianti opache erano anche più resistenti al lisozima umano, al peptide antimicrobico correlato alla catelicidina LL37 e al perossido di idrogeno rispetto alle colonie traslucide (Chin et al., 2018). Inoltre, gli isolati opachi avevano una maggiore tolleranza alle condizioni essiccate e alle controparti traslucide fuori concorrenza in un modello di infezione del topo (Chin et al., 2018). Poiché molteplici fattori sono coinvolti nella variazione di fase, sono stati condotti ulteriori studi per determinare il contributo della produzione di CPS al fenotipo opaco più virulento., In una pubblicazione successiva, gli autori hanno dimostrato che una variante acapsulare era significativamente più suscettibile al lisozima e ai disinfettanti rispetto al suo genitore opaco AB5075 wild-type (Tipton et al., 2018). È interessante notare che non vi era alcuna differenza nella resistenza all’LL-37 e al perossido di idrogeno tra i ceppi opachi wild-type e acapsular, suggerendo fattori diversi dalla produzione di CPS che portano a questo fenotipo per le varianti opache di A. baumannii (Tipton et al., 2018).,
Regolazione della produzione di CPS
Segnali ambientali, come temperatura, pressione osmotica e cambiamenti nella disponibilità di metaboliti e ioni possono influenzare la produzione batterica di CPS (Hagiwara et al., 2003; Lai et al., 2003; Mouslim et al., 2004; Willenborg et al., 2011). Non sorprende che siano stati identificati pochi meccanismi normativi per la produzione di CPS poiché i livelli di CPS sono comunemente regolati post-traduzionalmente attraverso la fosforilazione di macchinari per l’esportazione di CPS (Whitfield e Paiment, 2003; Chiang et al., 2017). In A., baumannii, solo due regolatori della produzione di capsule sono stati finora identificati; BfmRS e Omr-EnvZ, entrambi sistemi di trasduzione del segnale a due componenti che svolgono molteplici ruoli normativi coinvolti nella biogenesi dell’involucro (Geisinger e Isberg, 2015; Tipton e Rather, 2017; Geisinger et al., 2018). Quando sottoposto a pressione antibiotica, l’espressione di A. baumannii ATCC 17978 cps è stata aumentata in modo dipendente da BfmRS (Geisinger e Isberg, 2015). La variazione di fase, e quindi potenzialmente la produzione di CPS, è altamente regolata dal sistema OmpR-EnvZ in A., baumannii AB5075, poiché le mutazioni in Omr o EnvZ hanno determinato un aumento significativo della frequenza di commutazione da opaca a traslucida (Tipton e Rather, 2017). Sebbene la transizione da traslucido a risultati opachi in un aumento di due volte nello spessore della capsula, le analisi trascrittomiche non hanno identificato alcuna differenza nei livelli di espressione dei geni KL tra le due fasi.
CPS come obiettivo per lo sviluppo di vaccini e trattamenti contro A. baumannii
Antibiotico (in particolare cabapenem) resistente A., i baumannii sono classificati come organismo critico di priorità 1 dell’Organizzazione Mondiale della sanità per lo sviluppo di nuovi antimicrobici (OMS, 2017). Sebbene non ci siano attualmente trattamenti non antibiotici o vaccini autorizzati per A. baumannii, vi è un maggiore interesse per il loro sviluppo e gli studi preliminari sembrano promettenti. L’esposizione superficiale e la prevalenza nei ceppi patogeni di A. baumannii rendono la CPS un bersaglio ideale sia per i trattamenti antimicrobici che per i vaccini (Russo et al., 2013)., Questi includono lo sviluppo di terapie basate su anticorpi come vaccini profilattici, immunizzazione passiva e terapia fago (García-Quintanilla et al., 2013).
Diversi studi hanno dimostrato l’efficacia dell’immunizzazione passiva nei topi utilizzando un anticorpo specifico CPS, che è protettivo contro la sfida batterica con il 13-55% degli isolati clinici di A. baumannii (Russo et al., 2013; Yang et al., 2017; Lee et al., 2018)., Inoltre, l’inoculazione con vaccini coniugati che incorporano glicani CPS attaccati a un vettore proteico suscita una migliore protezione immunitaria rispetto al CPS purificato contro una vasta gamma di ceppi di A. baumannii (Yang et al., 2017).
L’interesse per la terapia dei fagi per il trattamento delle infezioni batteriche è aumentato negli ultimi anni in risposta all’attuale crisi della crescente resistenza antimicrobica. La terapia del fago è attraente come viale potenziale del trattamento per le infezioni multiresistenti di A. baumannii., Ad esempio, un fago che codifica una depolimerasi CPS è stato trovato per degradare il CPS di circa il 10%, quattro su 38, clinico multiresistente A. baumannii testato (Hernandez-Morales et al., 2018). Sebbene l’intervallo ospite di questo fago sia limitato, potrebbe essere incorporato come parte di un cocktail di fagi per massimizzare l’efficacia o mirare a focolai specifici (Hernandez-Morales et al., 2018). Un fago che fende selettivamente il legame di A., baumannii CPS in un ramo di acido pseudaminico può essere prezioso per la terapia dei fagi, o per produrre in modo efficiente CPS purificato per lo sviluppo di vaccini e anticorpi (Lee et al., 2018). Fago targeting A. baumannii sono stati recentemente dimostrato di essere stabile quando impregnato in burn prodotti per la cura della ferita in una serie di condizioni, tra cui in presenza di antimicrobici (Merabishvili et al., 2017). Tuttavia, poiché la maggior parte degli studi che indagano i CPS di A. baumannii sono solitamente limitati a un particolare ceppo di A. baumannii, non è noto se questi risultati si traducano in tutti gli A., baumannii isola o se sono ceppo o capsula tipo specifico. Capire quali ruoli capsula gioca in più ceppi è fondamentale per identificare i tipi di CPS che rappresentano i migliori obiettivi per i nuovi vaccini, o se lo sviluppo di antimicrobici targeting capsula biosintesi pathway è davvero anche fattibile.
Osservazioni conclusive
Sebbene la capsula rappresenti un importante tratto di virulenza di A. baumannii, sono disponibili dati limitati sul ruolo che i diversi tipi di CPS svolgono nel causare la malattia., Per sviluppare vaccini e terapie efficaci mirati alla CPS, dobbiamo prima acquisire una comprensione completa dei meccanismi alla base della sua sintesi ed espressione, insieme ai vantaggi che la capsula trasmette ai batteri ospiti. Questa ricerca deve essere affrontata nel contesto della variazione estrema dei sierotipi CPS trovati in A. baumannii, per garantire che i potenziali interventi funzionino contro ceppi che producono diverse strutture CPS., Ulteriori studi sulla CPS sono necessari per fornire una piattaforma per lo sviluppo di misure preventive e trattamenti contro questo patogeno umano sempre più persistente e mortale.
Contributi dell’autore
JS ha scritto la prima bozza. MB ha fornito input accademico e revisione critica dell’articolo. FA prodotto allineamenti del genoma e ha fornito revisione critica del manoscritto. Tutti gli autori hanno approvato la versione finale.
Finanziamento
Questo lavoro è stato sostenuto da una sovvenzione Flinders Medical Research Foundation a MB. FA è stato sostenuto da AJ e IM Naylon e Playford Trust Ph. D., Scholarship. JS è stato supportato da una borsa di studio AJ e IM Naylon.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Traub, WH (1989). Acinetobacter baumannii sierotipizzazione per la delineazione di focolai di infezione incrociata nosocomiale. J. Clin. Microbiolo. 27, 2713–2716.<| p>
PubMed Abstract/Google Scholar
Whitfield, C., e Paiment, A. (2003)., Biosintesi e assemblaggio di polisaccaridi capsulari del Gruppo 1 in Escherichia coli e polisaccaridi extracellulari correlati in altri batteri. Carboidrato. Res. 338, 2491-2502. doi: 10.1016 / j.carres.2003.08.010<| p>
PubMed Abstract | CrossRef Full Text/Google Scholar
WHO (2017). Elenco prioritario globale dei batteri resistenti agli antibiotici per guidare la ricerca, la scoperta e lo sviluppo di nuovi antibiotici. Ginevra: Organizzazione Mondiale della Sanità.
Google Scholar
