ESEMPIO – Previsione della polarità molecolare:
Decidese le molecole rappresentate dalle seguenti formule sono polari ononpolari. (Potrebbe essere necessario disegnare strutture Lewis e schizzi geometrici a doso.)
un. CO2 b. 2 c. CCl4 d. CH2Cl2 e. HCN
Soluzione:
un. La struttura di Lewis per la CO2
L’elettronegatività di carbonio e oxygenare 2.55 e 3.44. Il 0.,89 la differenza di elettronegatività indica che i legami theC-O sono polari, ma la disposizione simmetrica di questi legami rende la molecola non polare.
Se mettiamo le frecce nello schizzo geometrico per CO2, vediamo che si bilanciano esattamente l’un l’altro, in entrambe le direzioni emagnitudine. Questo mostra la simmetria dei legami.
b., La struttura di Lewis per OF2 è

Le elettronegatività di ossigeno e fluoro,3.44 e 3.98, rispettivamente, producono una differenza di 0.54 che ci porta a predittoche i legami O-F sono polari. La geometria molecolare di OF2 è piegata. Suchan distribuzione asimmetrica di legami polari produrrebbe una molecola polare.
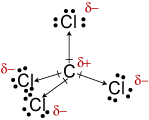
c. La geometria molecolare di CCl4 istetrahedral., Anche se i legami C-Cl sono polari, la loro disposizione simmetrica rende la molecola non polare.
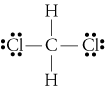
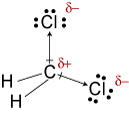
d. TheLewis struttura per CH2Cl2 è
L’elettronegatività di idrogeno, carbonio, andchlorine 2,20, 2.55, e 3.16. La differenza di 0,35 di elettronegatività peri legami H-C ci dicono che sono essenzialmente non polari. Il 0.,61differenza in elettronegatività per i legami C-Cl mostra che essi arepolar. I seguenti schizzi geometrici mostrano che i legami polari sonosimmetricamente disposti, quindi la molecola è polare. (Si noti che la Lewisstructure sopra suggerisce erroneamente che i legami sono disposti simmetricamente.Tieni presente che le strutture di Lewis spesso danno una falsa impressione della geometriadelle molecole che rappresentano.)

e., TheLewis struttura e disegno geometrico per HCN sono gli stessi:
Le elettronegatività di idrogeno,carbonio e azoto sono 2.20, 2.55 e 3.04. La differenza di 0,35 inelettronegatività per il legame H-C mostra che è essenzialmente non polare. La differenza di elettronegatività 0.49 per il legame C-N ci dice che è polare.Le molecole con un legame polare sono sempre polari.