Qual è la definizione di Indicatore in chimica
Indicatore
Gli indicatori sono sostanze che mostrano un cambiamento di colore quando vengono portati a contatto con acidi e basi.
L’indicatore più comune utilizzato in laboratorio è la tornasole. Viene estratto dai licheni ed è disponibile sotto forma di soluzioni o sotto forma di strisce di carta note come cartina di tornasole. La cartina di tornasole è di colore rosso o blu. Cambia colore a seconda che il composto sia un acido o una base., La cartina di tornasole blu diventa rossa in condizioni acide e la cartina di tornasole rossa diventa blu in condizioni di base.
Le soluzioni che non mostrano cambiamenti di colore in nessuno degli indicatori non sono né acide né basiche. Queste sostanze, come già sapete, sono chiamate sostanze neutre. Alcuni esempi di sostanze neutre sono acqua, cloruro di sodio, zucchero, ecc.
Il tornasole, l’arancio metilico e la fenolftaleina sono alcuni degli indicatori acido-base più comunemente usati che cambiano colore come segue.,td>
Methyl orange
Phenolphthalein
Litmus : It is a natural dye made from small plants called lichens., Le soluzioni di tornasole blu e rossa sono preparate da due diverse varietà di licheni.
Cartina di tornasole : la cartina di tornasole blu o rossa viene preparata immergendo una striscia di carta da filtro in soluzioni di tornasole blu o rossa. La carta viene quindi rimossa dalla soluzione e asciugata.
La cartina di tornasole blu diventa rossa in una soluzione acida e la cartina di tornasole rossa blu in una soluzione di base.
Fenolftaleina: è un composto incolore. Una soluzione alcolica di fenolftaleina viene utilizzata come indicatore., È incolore in una soluzione acida, ma diventa rosa (rosso) in soluzione basica:
Arancio metilico : Una quantità molto piccola di arancio metilico solido viene sciolta in acqua calda e filtrata. Il filtrato viene utilizzato come indicatore. Diventa rosso nelle soluzioni acide e giallo nelle soluzioni di base.
Indicatori universali
Gli acidi o le basi possono essere forti o deboli. Gli scienziati hanno reso molto facile conoscere la forza di un acido o di una base. Diversi punti di forza sono stati dati quello che è noto come un numero di pH che varia da 1 a 14., Uno è considerato fortemente acido e 14, fortemente basico; 7 è neutro. È possibile misurare il pH di una soluzione utilizzando un acidi o basi può essere forte o debole. Gli scienziati hanno reso molto facile conoscere la forza di un acido o di una base. Diversi punti di forza sono stati dati quello che è noto come un numero di pH che varia da 1 a 14. Uno è considerato fortemente acido e 14, fortemente basico; 7 è neutro. È possibile misurare il pH di una soluzione utilizzando un indicatore universale.
Un indicatore universale è una miscela di indicatori scelti in modo da dare un colore diverso per diversi valori di pH., L’indicatore può essere utilizzato come liquido o può essere immerso nella carta. Questo documento è chiamato carta pH.
Quando una carta pH è immersa in un acido o in una base, il colore ottenuto può essere abbinato alla tabella riportata di seguito.

Indicatori naturali:
Alcuni utili indicatori naturali sono discussi di seguito.
(i) Succo di curcuma È di colore giallo. Rimane giallo in soluzioni acide o neutre ma diventa marrone scuro in una soluzione basica.
(ii) Succo di cavolo rosso Stesso di colore viola, diventa rosso in una soluzione acida, ma verde in una soluzione basica.,
Le soluzioni indicatrici possono essere preparate facendo bollire parti colorate della pianta, come i petali, in acqua per qualche tempo e sforzando la parte della pianta. Questa soluzione dà un colore diverso nelle soluzioni acide e basiche.
Ad esempio, il succo di cavolo rosso cambierà in rosso intenso con acidi, in viola con neutri e in verde e giallo con basi. Il succo di cipolla mostra anche cambiamenti di colore simili. Puoi mettere direttamente alcuni petali di rosa in un piatto contenente aceto o succo di limone e alcuni petali in soluzione di sapone e vedere la differenza di colore.,
Gli indicatori domestici possono essere utilizzati per verificare se alcune delle sostanze di uso quotidiano elencate di seguito sono acide o basiche.,”d4ee238131″>Vitamine C tablets
(ascorbic acid)
Lemon juice
Orange juice
Tomato juice
Vinegar
Antacids
Toothpaste
Soap solution
Washing soda solutions
Olfactory indicators :
There are substances like onion juice, vanilla essence and clove oil which by change of their smell indicate whether the sample solution is acidic or basic., Questi sono chiamati indicatori olfattivi.
Hai imparato che nelle reazioni di neutralizzazione un acido e una base reagiscono per produrre sale e acqua. Ad esempio, la reazione di neutralizzazione tra NaOH e HCl dà il sale NaCl e acqua.
NaOH + HCl → NaCl + H2O
Quindi, un sale può essere definito come segue.
Un sale è un composto formato dalla reazione di un acido con una base in cui l’idrogeno dell’acido viene sostituito dal metallo.
In acidi polibasici, più di un atomo di idrogeno sono presenti in una molecola. Questi atomi di idrogeno possono essere sostituiti parzialmente o completamente., Quindi, sono possibili due tipi di sali.
(i)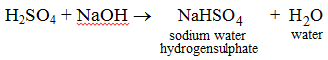
Qui, la sostituzione parziale degli atomi di idrogeno da H2SO4 ha portato alla formazione di idrogenosolfato di sodio.
(ii)![]()
Qui, la sostituzione completa degli atomi di idrogeno da H2SO4 ha portato alla formazione di solfato di sodio. NaHSO4 e Na2SO4 rappresentano due tipi di sali.
Attività
Obiettivo: Vedere l’effetto di un indicatore naturale
Materiali necessari: polvere di curcuma, alcool/acqua, soluzione di sapone e becher Metodo: –
1., Mescolare 1/4 cucchiaino di polvere di curcuma (haldi) in 1/4 di tazza di alcol in un piccolo becher. Puoi anche mescolarlo con acqua ma la curcuma si dissolve meglio nell’alcol.
2. Preparare una soluzione di sapone in un altro becher sciogliendo un piccolo pezzo di sapone da lavaggio in acqua.
3. Aggiungere alcune gocce della soluzione alcolica di curcuma alla soluzione di sapone.
Osservazione: La soluzione di sapone diventa rossa.
Conclusione: il sapone è una base e il composto (chiamato curcumina) che dà alla curcuma il suo colore giallo
reagisce con il sapone (una base) per formare un composto rosso.
