Trifluoruro di azoto Proprietà chimiche, usi, produzione
Descrizione
Il trifluoruro di azoto è un gas incolore con poco odore. Il trifluoruro di azoto è un ossidante che è alloranodinamicamente stabile tranne che a temperature elevate. A temperature fino a circa 482 ° F (250°C), la sua reattività è paragonabile all’ossigeno. A temperature più elevate, la sua reattività è simile al fluoro a causa della dissociazione apprezzabile in NF2 e F -., La dissociazione thennal del trifluoruro dell’azoto è stata studiata da un certo numero di ricercatori ed è stata trovata al picco nella gamma di temperature di 1100K a 1500K. Nella manipolazione del trifluoruro dell’azoto, le circostanze dovrebbero essere evitate che possono provocare le alte temperature quale compressione adiabatica dalla pressurizzazione rapida di un sistema.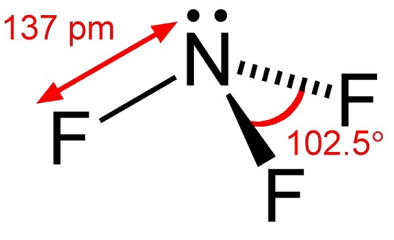
Il trifluoruro di azoto agisce principalmente sugli elementi come agente fluorurante, ma non molto attivo a temperature più basse., A temperature elevate, il trifluoruro di azoto pirolizza con molti degli elementi per produrre tetrafluoruro di azoto e il fluoruro corrispondente. La pirolisi del trifluoruro di azoto su torniture di rame produce tetrafluoruro di azoto in un 62 per cento al 71 per cento resa a 707 ° F (375°C). La pirolisi sul carbonio è più completa.
Proprietà chimiche
Il trifluoruro di azoto è un gas incolore. Moldyodor. Spedito come gas compresso non liquido.
Proprietà fisiche
Gas incolore; odore ammuffito; liquefa a -128,75°C; densità del liquido 3.,116 g/mL; pressione di vapore a -158°C 96 torr; solidifica a -206,8°C; temperatura critica -39,15 ° C; pressione critica 44,02 atm; volume critico 126 cm3/mol; molto leggermente solubile in acqua.
Usi
Il trifluoruro dell’azoto è un agente di pulizia della camera e dell’incisione.
Ossidante per combustibili ad alta energia, sintesi chimica.
Usi
Il trifluoruro di azoto è un gas costituito da atomi di azoto e fluoro., L’industria elettronica globale utilizza trifluoruro di azoto nei suoi processi di pulizia, perché il gas supera altre alternative, è più facile e sicuro da gestire e aiuta a ridurre le emissioni di gas serra.
I produttori di semiconduttori, celle solari a film sottile e display a schermo piatto utilizzano trifluoruro di azoto per pulire le camere di processo. All’interno delle camere, sottili strati di film semiconduttori e isolanti vengono applicati a wafer e pannelli., Il trifluoruro dell’azoto rimuove il residuo che questi film lasciano sulle pareti della camera in modo dalle camere può funzionare efficientemente e produrre un dispositivo di qualità.
Il trifluoruro di azoto offre molti vantaggi rispetto ai detergenti alternativi. È stabile a temperatura ambiente, quindi è relativamente facile e sicuro da gestire. È anche facile usare il trifluoruro di azoto per formare un gas energetico, o reattivo, o un plasma—un gas con elettroni liberi. La durata relativamente lunga dei radicali del fluoro prodotti nel plasma rende il trifluoruro di azoto un detergente efficiente.,
Usi
Il trifluoruro di azoto è stato utilizzato con successo in grandi quantità come fonte di fluoro per laser chimici ad alta energia. È overfluorine preferito a causa della sua facilità comparativa di trattamento alle circostanze ambientali.
Recentemente, una quantità crescente di nitrogentrifluoruro viene utilizzata nell’industria dei semiconduttori come etchant secco, mostrando tassi di incisione e selettività significativamente più elevati rispetto al tetrafluoruro di carbonio e alle miscele di tetrafluoruro di carbonio e ossigeno.,
Trifluoruro di azoto è stato utilizzato anche come ossidante in missilistica nei primi anni 1960, ma thisapplication non è stato commercializzato.
Preparazione
Il trifluoruro di azoto viene preparato per elettrolisi di fluoruro di ammonio fuso, NH4F, o fluoruro di acido ammonio fuso, NH4HF2 (o fluoruro di ammonio in HF anidro). Mentre il metodo NH4F è preferito perché forma trifluoruro di azoto come unico prodotto, l’elettrolisi del fluoruro di acido ammonico produce una piccola quantità di difluoruro di dinitrogeno,N2F2 e NF3.,
Inoltre, trifluoruro di azoto può essere preparato per reazione di ammoniaca con fluoro diluito con azoto in un reattore imballato con rame. Altri fluoruri dell’azoto, quali N2F2, N2F4 e NHF2 inoltre sono prodotti. La resa del prodotto principale dipende dal rapporto fluoro / ammoniaca e da altre condizioni.
Metodi di produzione
Il trifluoruro di azoto può essere formato da un’ampia varietà di reazioni chimiche. Il processo commerciale per la produzione prevede la fluorurazione diretta dell’ammoniaca con gas fluoro in presenza difluoruro di ammonio.,
Reazioni
L’idrogeno reagisce con il trifluoruro di azoto con la rapida liberazione di grandi quantità di calore ed è la base per l’uso del trifluoruro di azoto nei laser chimici ad alta energia. La gamma di infiammabilità per le miscele trifluoruro-idrogeno dell’azoto è di 9,4 mole per cento al trifluoruro dell’azoto di 95 mole per cento. Il trifluoruro dell’azoto reagisce con i composti organici, ma generalmente una temperatura elevata è richiesta per iniziare la reazione., In queste condizioni, la reazione procederà spesso in modo esplosivo e si deve prestare molta attenzione quando si espone il trifluoruro di azoto a composti organici. Pertanto, il trifluoruro di azoto ha trovato poco uso come agente fluorurante per composti organici.
Descrizione generale
Un gas incolore con un odore ammuffito. Molto tossico per inalazione. Leggermente solubile in acqua. Corrosivo per il tessuto. In caso di esposizione prolungata al fuoco o calore i contenitori possono rompersi violentemente e razzo. Usato per fare altri prodotti chimici e come componente dei combustibili del razzo.,
Aria & Reazioni acquose
Leggermente solubile in acqua.
Profilo di reattività
Il trifluoruro di azoto è un agente ossidante molto potente. Presenta pericolo di incendio pericoloso in presenza di agenti riducenti. Incide il vetro in presenza di umidità. Emette fumi tossici e corrosivi di fluoro quando riscaldato alla decomposizione . Può reagire violentemente con idrogeno, ammoniaca, monossido di carbonio, diborano, idrogeno solforato, metano, tetrafluoroidrazina, carbone. Reazione esplosiva con biossido di cloro., Una grave esplosione può verificarsi quando esposto ad agenti riducenti sotto pressione .
Pericolo
Grave pericolo di esplosione. Corrosivo per il tessuto. Metaemoglobinemia, danni al fegato e ai reni.
Pericolo per la salute
L’inalazione di trifluoruro di azoto può ridurre la capacità dei globuli rossi di trasportare ossigeno. Ciò causa cianosi o una decolorazione bluastra della pelle. Respirazione trifluoruro di azoto può anche portare a mal di testa, vertigini, debolezza e confusione., Dopo un’esposizione prolungata ad alte concentrazioni, la degradazione dei globuli rossi e i cambiamenti nel fegato, nei reni, nella milza e nel muscolo cardiaco possono verificarsi come effetti secondari. All’aria aperta, i cambiamenti iniziali dei globuli rossi si cancelleranno per diverse ore, ma la persona dovrebbe comunque essere monitorata per gli effetti secondari.
Pericolo di incendio
La sostanza non brucia ma supporta la combustione. Alcuni possono reagire in modo esplosivo con i combustibili. Può accendere combustibili (legno, carta, olio, abbigliamento, ecc.). I vapori del gas liquefatto sono inizialmente più pesanti dell’aria e si diffondono lungo il terreno., Il deflusso può creare pericolo di incendio o esplosione. I contenitori possono esplodere quando riscaldati. Cilindri rotti possono razzo.
Usi industriali
Il trifluoruro di azoto è stato utilizzato con successo in grandi quantità come fonte di fluoro per laser chimici ad alta energia. È preferito sopra fluoro a causa della sua facilità comparativa di trattamento alle circostanze ambientali.,
Recentemente, una quantità crescente di trifluoruro di azoto viene utilizzata nell’industria dei semiconduttori come etchant secco, mostrando tassi di incisione e selettività significativamente più elevati rispetto al tetrafluoruro di carbonio e alle miscele di tetrafluoruro di carbonio e ossigeno.
Trifluoruro di azoto è stato utilizzato anche come ossidante in missilistica nei primi anni 1960, ma questa applicazione non è stata commercializzata.
Usi materiali
A temperature inferiori a 482°F (250°C), il trifluoruro di azoto ha una reattività simile a quella dell’ossigeno ed è relativamente inerte alla maggior parte dei materiali di costruzione., A temperature ambiente, ottone, alluminio, rame, acciaio e acciai inossidabili possono essere utilizzati a causa di tassi di corrosione inferiori a 0,1 mil / anno. a 160 ° F (71.1°C) sono stati determinatiper questi materiali. Il trifluoruro dell’azoto è alsocompatible con i materiali fluorurati tale asTeflon all’ambiente temperatures.At aumento delle temperature e delle pressioni, la reattività del trifluoruro di azoto aumenta diventando più simile a quella del fluoro, con nichel andMonel essere i materiali preferiti di costruzione.
Profilo di sicurezza
Un veleno. Leggermente tossico per inalazione., L’assorbimento prolungato puòcausare screziature dei denti, cambiamenti scheletrici.Grave pericolo di esplosione per reazione chimica con agenti riducenti, in particolare quando sotto pressione. Un pericolo di incendio molto pericoloso; un ossidatore molto potente; altrimenteinert a temperature e pressioni normali.
Esposizione potenziale
Questo materiale è stato utilizzato nella sintesi chimica e come ossidante per combustibili ad alta energia (come ossidante nelle combinazioni di propellenti per razzi).
Effetti fisiologici
ACGIH raccomanda una media ponderata del valore limite di soglia (TLV-TWA) di 10 ppm (29 mgim3) per il trifluoruro di azoto., TheTLV-TWA è la concentrazione media ponderata nel tempo per un giorno lavorativo nonnale di 8 ore e una settimana lavorativa di 40 ore, a cui quasi tutti i lavoratori possono essere ripetutamente esposti, giorno dopo giorno, senza effetti negativi.
OSHA elenca un limite di esposizione media ponderata nel tempo di 8 ore (TWA-PEL)di 10 ppm (29 mg/m3) per il trifluoruro di azoto.TWA-PEL è il limite di esposizione che non deve essere superato dal TWAin 8 ore qualsiasi turno di lavoro di 8 ore di una settimana lavorativa di 40 ore.,
La tossicità del trifluoruro di azoto è relatedto la sua capacità di fonn metaemoglobina, un fonn modificato di emoglobina incapace di oxygentransport, e di distruggere i globuli rossi(emolisi). Dopo la cessazione dell’esposizione, la metaemoglobina ritorna spontaneamente all’emoglobina. Tuttavia, ad alti livelli di esposizione,può essere necessario un intervento terapeutico (ossigeno, blu di metilene, trasfusione di scambio). Theoccurrence di emolisi richiede il monitoraggio attento per grado di anemia e la funzione renale forimpaired potenziale.,
Il valore TLV-TWA del trifluoruro di azoto di 10ppm è risultato da uno studio che ha esposto i ratti a 100 ppm per 7 ore al giorno, 5 giorni alla settimana per 18 mesi. Non sono stati rilevati cambiamenti nei comportamenti degli animali, nei tassi cardiaci o polmonari, nei livelli di sangue o nell’aspetto della fluorosi. ACGIH ha fissato il TLV-TWA a III 0 del livello di prova.
Il trifluoruro di azoto gassoso è considerato innocuo per la pelle e un irritante minore per gli occhi e le mucose.
stoccaggio
I cilindri del trifluoruro dell’azoto devono essere sostenuti saldamente mentre sono in uso per impedire il movimento e la tensione dei collegamenti., I cilindri pieni devono essere conservati in un’area ben ventilata, protetti da calore eccessivo (125 ° F o 51,7°C), situati lontano da materiali organici o infiammabili e fissati. I tappi di protezione delle valvole e i tappi di uscita delle valvole devono essere sempre saldamente in posizione quando il cilindro non è in uso.
Spedizione
UN2451 Trifluoruro di azoto, Classe di pericolo: 2.2; Etichette: 2.2-Gas compresso non infiammabile; 5.1-Ossidante.I cilindri devono essere trasportati in posizione verticale sicura, in un camion ben ventilato. Proteggere il cilindro e le etichette dadanni fisici., Il proprietario della bombola di gas compressoè l’unica entità consentita dalla legge federale (49CFR) per trasportarli e riempirli. È una violazione delle regole di trasporto per riempire le bombole di gas compresso senza il permesso scritto espresso del proprietario.
Valutazione della tossicità
La tossicità del trifluoruro di azoto è correlata alla sua capacità di fonn metaemoglobina, un fonn modificato di emoglobina incapace di trasporto dell’ossigeno e di distruggere i globuli rossi (emolisi). Dopo la cessazione dell’esposizione, la metaemoglobina ritorna spontaneamente all’emoglobina., Tuttavia, ad alti livelli di esposizione, può essere necessario un intervento terapeutico (ossigeno, blu di metilene, trasfusione di scambio). L’insorgenza di emolisi richiede un attento monitoraggio del grado di anemia e del potenziale di compromissione della funzionalità renale.
Incompatibilità
Il gas è un potente ossidante. Presentesperoso pericolo di incendio in presenza di agenti riducenti. Incide il vetro in presenza di umidità., Reagisce conolio, grasso, agenti riducenti e altri materiali ossidabili;combustibili, sostanze organiche, ammoniaca,monossido di carbonio; metano, idrogeno,idrogeno solforato; carbone attivo; diborano, acqua. Può reagire violentemente con idrogeno,ammoniaca, monossido di carbonio, diborano, idrogeno solforato, metano,tetrafluoroidrazina, carbone. Il trifluoruro di azoto aumenterà l’intensità di un incendio esistente.
Smaltimento dei rifiuti
Restituire bombole di gas compresse ricaricabili al fornitore., Sfiato in grande volume di concentratosoluzione di agente riducente (bisolfiti, sali ferrosi o ipo), quindi neutralizzare e lavare in fogna con grandevolumi d’acqua.
GRADI DISPONIBILI
Il trifluoruro di azoto è disponibile in gradi che vanno dal 98% al 99,995% di purezza v/vminimum.
