wprowadzenie
zakażenia szpitalne wywołane przez oporne na wiele leków Acinetobacter baumannii stają się coraz bardziej powszechne na całym świecie, szczególnie w warunkach intensywnej opieki medycznej (Wieland et al., 2018). Powodzenie tej bakterii jest ułatwione przez jej zdolność do przetrwania w różnych środowiskach potęgowane przez jej szybką zdolność do nabywania odporności wielolekowej. Węglowodany powierzchniowe odgrywają kluczową rolę w ogólnej sprawności i zjadliwości A., baumannii (Lees-Miller et al., 2013; Geisinger and Isberg, 2015; Weber et al., 2016). A. baumannii produkuje polisacharyd otoczkowy o dużej masie cząsteczkowej (CPS), który otacza błonę zewnętrzną (Rysunek 1) (Russo et al., 2010). Składa się z ściśle upakowanych powtarzających się podjednostek Oligosacharydowych (jednostek K), CPS tworzy dyskretną warstwę na powierzchni bakterii, zapewniając ochronę przed różnymi warunkami środowiskowymi, pomagając w unikaniu obrony immunologicznej gospodarza i zwiększając odporność na szereg związków przeciwbakteryjnych (Russo et al., 2010; Iwaszkiw i in., 2012; Geisinger i Isberg, 2015).,
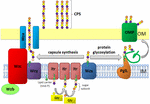
Rysunek 1. Schematyczne przedstawienie montażu i eksportu polisacharydów kapsułkowych u A. baumannii. Synteza rozpoczyna się od początkowej transferazy (Itr; bordowa) znajdującej się w błonie wewnętrznej (IM) przenoszącej pierwszy cukier powtarzającej się jednostki na nośnik lipidów (Und-P; zielone koło). Kolejne cukry są następnie dodawane do jednostki wzrostu przez specyficzne glikozylotransferazy (GTR; żółty) po cytozolowej stronie błony wewnętrznej., Podjednostka kapsuły (Jednostka K) jest następnie przenoszona do peryplazmy przez integralne białko błonowe Wzx (ciemnoniebieski). Podjednostki cukru są polimeryzowane przez białko Wzy (fioletowy), a kompleks Wza/Wzb/Wzc (cyjan, wapno, czerwień) koordynuje polimeryzację wysokiego poziomu i eksport łańcucha wzrostu, przenosząc je do błony zewnętrznej (OM). W przypadku glikozylacji PglL (pomarańczowy) łączy jednostki K z wybranymi białkami błony zewnętrznej (OMP; ciemnozielony).
u A. baumannii montaż i eksport kapsułek odbywa się drogą zależną od Wyy (Hu et al.,, 2013; Kenyon and Hall, 2013; Willis and Whitfield, 2013; Woodward and Naismith, 2016) (Rysunek 1). Zazwyczaj składa się z 4-6 cukrów, Jednostka K jest montowana na cząsteczce nośnika lipidów pirofosforanu undekaprenylu (Und-P), który stanowi rusztowanie dla rosnącego łańcucha cukrowego (Whitfield, 2006). Pierwszy cukier w jednostce K jest rekrutowany przez początkową transferazę związaną z błoną wewnętrzną (im) (Itr), a następnie sekwencyjny dodatek cukrów do rosnącej jednostki K przez specyficzne enzymy transferazy glikozylowej (GTR) (Rysunek 1) (Woodward and Naismith, 2016)., Każda jednostka K jest następnie przenoszona na peryplazmatyczną stronę IM przez translokazę Wzx i polimeryzowana przez Wzy, która przenosi rosnący łańcuch polisacharydowy z jednego nośnika Und-P do następnej nadchodzącej podjednostki (Rysunek 1) (Collins et al., 2007). Po zsyntetyzowaniu polimeru CPS jest on transportowany na powierzchnię komórki w wysoce skoordynowanym procesie obejmującym interakcję trzech białek; Wza, Wzb i Wzc, które składają się na maszynę eksportową (Rysunek 1)., Synteza CPS reprezentuje jedno ramię rozwidlonego szlaku, ponieważ te jednostki K są również używane do dekoracji niektórych białek powierzchniowych poprzez glikozylację białek o (Lees-Miller et al., 2013). W tym przypadku pojedyncze jednostki K są przenoszone do białek biorców przez O-Oligosacharylotransferazę PglL (Rysunek 1) (Iwashkiw et al., 2012). W A. baumannii, glikozylacja białka przyczynia się do tworzenia biofilmu poprzez zwiększenie początkowego przywiązania i dojrzewania biofilmów oraz patogenności, jak wykazano w wielu modelach infekcji zwierząt (Iwashkiw et al., 2012; Scott et al., 2014; Harding et al.,, 2015). Biofilm jest stanem wzrostu, w którym społeczności bakteryjne są zamknięte w matrycy egzopolisacharydowej i wykazano, że odgrywają znaczącą rolę w trwałości i odporności A. baumannii.
Inne powierzchniowe węglowodany, o których wiadomo, że wpływają na patogenność A. baumannii, to lipooligosacharyd (LOS) i egzopolisacharyd Poli-β-(1-6)-N-acetyloglukozamina (Pnag) (Preston et al., 1996; Weber et al., 2016). PNAG tworzy spójny „klej” biofilmów i stanowi znaczną część biofilmów (Choi et al., 2009; Longo et al., 2014)., W przeciwieństwie do większości bakterii Gram-ujemnych, A. baumannii nie wytwarza tradycyjnego lipopolisacharydu, ale zamiast tego podobny Gliko-koniugat powierzchniowy, LOS, składający się z lipidowego rdzenia A, który nie ma antygenu O (Kenyon and Hall, 2013; Kenyon et al., 2014b). Utrata produkcji LOS u A. baumannii zmniejsza stabilność błony zewnętrznej, co prowadzi do zmniejszenia sprawności (Moffatt et al., 2010; Beceiro et al., 2014).
chociaż wiele cząsteczek węglowodanów wpływa na patogenność, można argumentować, że CPS jest dominującym czynnikiem zjadliwości A. baumannii. Niniejszy przegląd ma na celu skonsolidowanie tego, co wiadomo o A., kapsuła baumannii obejmująca wybrane struktury, biosyntezę i organizację genów, rolę CPS w zjadliwości oraz potencjał CPS jako celu dla przyszłego rozwoju szczepionek i leków.
Organizacja genetyczna K Loci
wraz z pojawieniem się kompletnych genomów większej liczby izolatów A. baumannii staje się widoczna prawdziwa różnorodność struktur kapsułkowych obecnych w tej bakterii. Do tej pory ponad 100 unikalnych loci kapsułek (KL) zostały zidentyfikowane w A. baumannii (rysunek 2A) (Shashkov et al., 2017). Te regiony zwykle wahają się od 20 do 35 kb., Analiza genów kierujących syntezą CPS w dziesięciu kompletnych genomach A. baumannii doprowadziła pierwotnie do wyznaczenia dziewięciu typów kapsułek, KL1-KL9, co stało się podstawą uniwersalnego schematu typowania dla tych loci (Kenyon and Hall, 2013). System ten został następnie rozszerzony w celu uwzględnienia identyfikacji nowych K loci. Chromosomalna lokalizacja K locus, między genami fkpa i lldP, jest wysoce zachowana między szczepami A. baumannii i zawiera te geny wymagane do biosyntezy i eksportu specyficznego dla każdego typu CPS (Rysunek 2) (Hu et al.,, 2013; Kenyon i Hall, 2013). Wyjątkiem od tej reguły są szczepy A. baumannii posiadające regiony KL19 i KL39, gdzie gen kodujący polimerazę Wyy, wyy, znajduje się na małej wyspie genetycznej gdzie indziej na chromosomie (Kenyon et al., 2016a). Dodatkowo geny wymagane dla niektórych typowych cukrów widzianych w CPS znajdują się gdzie indziej., Wszystkie K loci wykazują podobną konfigurację genetyczną, wysoce zmienną klastrę genów syntezy i transferazy wymaganych do biosyntezy unikalnych cukrów złożonych typu KL, otoczonych z jednej strony wysoko zachowanymi genami eksportu CPS, a z drugiej strony zestawem genów kodujących konserwowane cukry proste i prekursory (ryc. 2A)., Geny wzx i wzy wymagane do przetwarzania powtarzalnych jednostek są bardzo zmienne między loci K (rysunek 2A, Jasnoniebieski), wskazując specyficzność dla poszczególnych struktur jednostek K i, ogólnie, kolejność determinantów gtr, kodujących specyficzne glikozylotransferazy w regionach KL, odwrotnie odpowiada kolejności działania.
zmienny region niektórych klastrów genów KL, takich jak KL37 i KL14, brakuje genów do syntezy cukru złożonego, ponieważ zawierają one tylko cukry proste w swoich jednostkach K (Arbatsky et al., 2015; Kenyon et al.,, 2015). Ponadto, dodając do swojej różnorodności, kilka regionów KL zawiera redundantne geny, które nie są potrzebne do syntezy ostatecznej jednostki K. Na przykład KL8 i KL9 zawierają dwa geny itr (Kenyon and Hall, 2013), a KL37 ma fosfogliceroltransferazę pgt1, ale nie ma odpowiedniej pozostałości fosfoglicerolu w ustalonej strukturze(Arbatsky et al., 2015). Ponadto w KL93 dwa elementy sekwencji wstawiania (ISAba26 i ISAba22) przerywają wyznacznik pgt1 (Rysunek 2) (Kasimova et al., 2017)., Geny wymagane do specyficznej biosyntezy cukru nie będą omawiane, ponieważ szlaki te zostały wcześniej omówione i wykraczają poza zakres niniejszego przeglądu (Hu et al., 2013; Kenyon i Hall, 2013). Dodatkowo, inne geny znajdujące się w obrębie KL kodują produkty, które mogą być zaangażowane w modyfikację acetylacji lub acylacji specyficznych glikanów (ryc. 2A, różowy). Chociaż badanie K loci może ujawnić wiele o strukturach jednostek K, analiza chemiczna i badania biochemiczne są wymagane w celu określenia dokładnych struktur i identyfikacji konkretnych powiązań między powtarzającymi się cukrami.,
struktury CPS
najwcześniejsze badania nad serotypem CPS A. baumannii były napędzane potrzebą opracowania metody rozróżniania izolatów A. baumannii od innych gatunków Acinetobacter, ponieważ analiza fenotypowa była obciążona dwuznacznością i błędną identyfikacją (Traub, 1989). Jak opisano powyżej, istnieje fenomenalna różnorodność obserwowana w klastrach genów biosyntezy CPS A. baumannii, co przekłada się na różnorodność obserwowaną w strukturze jednostki K (Hu et al., 2013; Kenyon i Hall, 2013). Łącznie ponad 40 różnych A., struktury jednostek baumannii K zostały do tej pory wyjaśnione za pomocą spektroskopii NMR i analizy chemicznej. Struktury jednostek K różnią się składem cukru. Mogą one obejmować pochodne zwykłych cukrów powiązanych UDP, takich jak glukoza, galaktoza i kwas glukuronowy lub rzadkie i nietypowe cukry, takie jak kwasy nie-2-ulosonowe. Struktury różnią się długością i mogą składać się tylko z dwóch pozostałości, jak widać dla K53 typu CPS (Shashkov et al., 2018), lub do pięciu lub sześciu monosacharydów, takich jak obserwowane w K37 (rysunek 2B) (Arbatsky et al., 2015)., Struktury różnią się również połączeniami zarówno wewnątrz, jak i między jednostkami K, co prowadzi do produkcji jednostek K, które są liniowe lub obejmują gałęzie boczne, jak widać w K1 i K93, odpowiednio (rysunek 2B) (Kenyon et al., 2016a; Kasimova i in., 2017). Różnice w lokalizacji specyficznych wiązań glikozydowych i wzorców o-acetylacji różnych oligosacharydów w strukturze również przyczyniają się do różnorodności jednostek K.,
różnice między strukturami jednostek K mogą być subtelne, na przykład K12 i K13 różnią się tylko połączeniem dwóch glikanów, co wymaga użycia alternatywnej polimerazy Wy; w związku z tym loci K obu szczepów są identyczne z wyjątkiem genu wy (ryc. 2). Alternatywnie zmiana może być uderzająca, na przykład włączenie rzadkich cukrów, w tym pochodnych pseudaminicznych, legionaminicznych lub kwasu acynetaminowego, jak widać odpowiednio w strukturach K2/6, K49 i K12/13 (Rysunek 2) (Kenyon et al., 2014a, 2015; Vinogradov et al., 2014; Kasimova i in., 2018)., Co ciekawe, pochodne kwasu acinetaminowego zostały zidentyfikowane tylko u A. baumannii i nie występują nigdzie indziej w przyrodzie (Kenyon et al., 2017). Dodatkowo, niektóre jednostki K zawierają unikalne pochodne specyficznych glikanów, na przykład kwas pseudaminowy K93 jest acetylowany z grupą (R)-3-hydroksybutanoilową (Kasimova et al., 2017), natomiast w K2 i K6 kwas pseudaminowy nie jest acetylowany (ryc. 2)., Ponadto struktura K4 jest wyjątkowa, ponieważ zawiera tylko aminosugary, D-QuipNAc i jedną końcową gałąź N-acetylo-D-galaktozaminy (D-GalpNAcA), która jest ograniczona grupą pirogronilową, rzadkim motywem i pierwszą opisaną w Acinetobacter (rysunek 2A, Czarny) (Kenyon et al., 2016b). Wraz ze wzrostem liczby wyjaśnionych struktur jednostek K wzrasta zaufanie do wnioskowania o strukturze jednostek K z analizy klastrów biosyntezy umieszczonych w KL A. baumannii., Jednak, choć pouczające, zrozumienie roli CPS odgrywa w patogenezie jest ważne, aby wykorzystać tę wiedzę do poprawy wyników zakażeń A. baumannii.
rola w zjadliwości, oporności na środki przeciwdrobnoustrojowe i trwałości
nie ulega wątpliwości, że obecność CPS jest niezbędna dla patogenności A. baumannii. Nie tylko jest to konieczne do uchylania się od obrony immunologicznej gospodarza (Russo et al., 2010; Geisinger and Isberg, 2015), ale jest to ważne dla odporności na związki przeciwbakteryjne i przeżycia w niekorzystnych środowiskach (Luke et al., 2010;,, 2010; Geisinger i Isberg, 2015). CPS pośredniczy w unikaniu odporności u wielu szczepów A. baumannii, ograniczając interakcje między immunogennymi strukturami powierzchniowymi bakterii a obronnością gospodarza (Preston et al., 1996; Wu et al., 2009;, 2010; Umland i in., 2012; Lees-Miller et al., 2013; Geisinger and Isberg, 2015; Wang-Lin et al., 2017). Zniesienie kapsułek w wielu różnych szczepach A. baumannii wykazało zmniejszone przeżycie w surowicy ludzkiej i płynie wodobrzusza, a tłumienie w modelach infekcji szczurów i myszy (Russo et al., 2010; Umland i in., 2012; Lees-Miller et al.,, 2013; Sanchez-Larrayoz et al., 2017). Ponadto regulacja produkcji kapsułek w powszechnie używanym szczepie A. baumannii ATCC 17978 (Typ K3 CPS) zwiększyła oporność i zjadliwość surowicy w modelu infekcji myszy (Geisinger and Isberg, 2015). Ponadto można opracować nowe metody leczenia przeciwdrobnoustrojowego dla określonych typów CPS, na przykład zawierających kwas pseudaminowy, ponieważ jego obecność koreluje ze zwiększoną zjadliwością (Hitchen et al., 2010; Kao et al., 2016).
oprócz ochrony przed obronnością hosta, w, produkcja baumannii CPS zwiększa odporność na szereg związków przeciwbakteryjnych, w tym stosowanych do dezynfekcji w warunkach klinicznych (Geisinger and Isberg, 2015; Tipton et al., 2015; Chen et al., 2017). Ponadto wzrost A. baumannii w sub-hamujących poziomach środków przeciwdrobnoustrojowych wpływa na produkcję CPS. Na przykład, ekspozycja na antybiotyki chloramfenikol lub erytromycyna doprowadziły do zwiększenia syntezy kapsułek w ATCC 17978 (Geisinger and Isberg, 2015) i ekspozycji meropenem wybrane dla mutacji prowadzących do utraty produkcji CPS w izolacie 37662 (Chen et al., 2017)., Badania przeprowadzone na szerszym zakresie szczepów A. baumannii są wymagane w celu określenia, czy ochrona przed środkami przeciwdrobnoustrojowymi zapewniana przez CPS jest specyficzna dla szczepu, specyficzna dla typu kapsułek lub uniwersalna.
zdolność A. baumannii do utrzymywania się w środowisku klinicznym niewątpliwie zwiększyła kolonizację i infekcje u podatnych pacjentów. A. baumannii jest w stanie przetrwać miesiące na powierzchniach szpitalnych, takich jak szyny łóżkowe, meble i urządzenia medyczne, zapewniając zbiornik, który często jest źródłem transmisji i infekcji (Wendt et al., 1997; Gayoso et al., 2013)., Uważa się, że niezwykła tolerancja na wysuszanie A. baumannii wynika ze strategii „bust lub boom”, w której trwała subpopulacja komórek przeżywa kosztem obumarłych komórek; CPS zwiększa tolerancję na wysuszanie, zapewniając fizyczną barierę ułatwiającą retencję wody (Roberts, 1996; Webster et al., 2000; Gayoso et al., 2013; Bravo et al., 2016). Bezpośrednią rolę CPS w odporności na osuszanie wykazano ostatnio w szczepie AB5075 A. baumannii (Typ K25 CPS). W badaniu tym wariant akapsularny AB5075 wykazał 2.,5-krotne zmniejszenie żywotności w porównaniu do szczepu rodzicielskiego (Tipton et al., 2018). Ponadto u dwóch bliskich krewnych A. baumannii, Acinetobacter calcoaceticus i Acinetobacter baylyi, wykazano, że produkcja egzopolisacharydów i / lub CPS sprzyja przetrwaniu wysuszenia (Roberson and Firestone, 1992; Ophir and Gutnick, 1994). Oprócz wpływania na odporność na wysuszanie, CPS był związany z innymi cechami zjadliwości, w tym ruchliwością (McQueary et al., 2012;, 2014) i produkcji biofilmu (Umland et al., 2012; Lees-Miller et al.,, 2013), utrwalając tym samym jego rolę jako czynnika chorobotwórczego.
ostatnie badania połączyły fenotyp zmienny fazowo A. baumannii AB5075 ze zmianami w produkcji CPS, ponieważ wysoce zjadliwe warianty nieprzezroczyste wytwarzają warstwę CPS o podwójnej grubości ich półprzezroczystych odpowiedników (Chin et al., 2018). To przejście z półprzezroczystego do nieprzezroczystego również znacznie zwiększyło potencjał patogenny A. baumannii AB5075. Zwiększono również oporność na typowe szpitalne środki dezynfekujące i podzbiór antybiotyków aminoglikozydowych (Tipton et al., 2015; Chin i in.,, 2018) i nieprzezroczyste warianty były również bardziej odporne na ludzki lizozym, związany z katelicydyną antybakteryjny peptyd LL37 i nadtlenek wodoru w porównaniu do przezroczystych Kolonii (Chin et al., 2018). Ponadto Izolaty nieprzezroczyste wykazywały zwiększoną tolerancję na warunki wysuszone i półprzezroczyste odpowiedniki w modelu infekcji myszy (Chin et al., 2018). Ponieważ w zmienności fazowej bierze udział wiele czynników, przeprowadzono dalsze badania w celu określenia udziału produkcji CPS w bardziej zjadliwym fenotypie nieprzezroczystym., W kolejnej publikacji autorzy wykazali, że wariant nakapsułkowy był znacznie bardziej podatny na lizozym i środki dezynfekujące w porównaniu do nieprzezroczystego rodzica ab5075 typu dzikiego(Tipton et al., 2018). Co ciekawe, nie było różnicy w odporności na LL-37 i nadtlenku wodoru między nieprzezroczystymi szczepami dzikiego i acapsular, co sugeruje, że czynniki inne niż produkcja CPS prowadzą do tego fenotypu dla nieprzezroczystych wariantów A. baumannii (Tipton et al., 2018).,
Regulacja produkcji CPS
sygnały środowiskowe, takie jak temperatura, ciśnienie osmotyczne i zmiany metabolitu i dostępności jonów mogą wpływać na produkcję bakteryjnego CPS (Hagiwara et al., 2003; Lai i in., 2003; Mouslim et al., 2004; Willenborg et al., 2011). Nie dziwi fakt, że zidentyfikowano kilka mechanizmów regulacyjnych dla produkcji CPS, ponieważ poziomy CPS są powszechnie regulowane posttranslacyjnie poprzez fosforylację maszyn eksportowych CPS (Whitfield and Paiment, 2003; Chiang et al., 2017). W A., baumannii, tylko dwa regulatory produkcji kapsułek zostały do tej pory zidentyfikowane; BfmRS i OmpR-EnvZ, oba dwuskładnikowe systemy transdukcji sygnału, które odgrywają wiele ról regulacyjnych zaangażowanych w biogenezę koperty (Geisinger and Isberg, 2015; Tipton and Rather, 2017; Geisinger et al., 2018). Po poddaniu presji antybiotykowej ekspresja A. baumannii ATCC 17978 cps została zwiększona w sposób zależny od BfmRS (Geisinger and Isberg, 2015). Zmienność fazowa, a tym samym potencjalnie produkcja CPS, jest wysoce regulowana przez system OmpR-EnvZ w A., baumannii AB5075, jako mutacje w OmpR lub EnvZ spowodowały znaczny wzrost nieprzezroczystej do półprzezroczystej częstotliwości przełączania (Tipton and Rather, 2017). Chociaż przejście z półprzezroczystego do nieprzezroczystego powoduje dwukrotne zwiększenie grubości kapsułek, analizy transkryptomiczne nie zidentyfikowały żadnych różnic w poziomie ekspresji genów KL między tymi dwoma fazami.
CPS jako cel opracowania szczepionek i metod leczenia przeciwko A. baumannii
opornych na antybiotyk (konkretnie kabapenem) A., baumannii są klasyfikowane jako priorytet Światowej Organizacji Zdrowia 1 organizm krytyczny dla rozwoju nowych środków przeciwdrobnoustrojowych (WHO, 2017). Chociaż obecnie nie ma licencji na leczenie bez antybiotyków ani szczepionek dla A. baumannii, wzrasta zainteresowanie ich rozwojem i wstępne badania wyglądają obiecująco. Ekspozycja powierzchniowa i częstość występowania w patogennych szczepach A. baumannii sprawia, że CPS jest idealnym celem zarówno dla terapii przeciwdrobnoustrojowych, jak i szczepionek (Russo et al., 2013)., Obejmują one rozwój terapii opartych na przeciwciałach, takich jak szczepionki profilaktyczne, uodpornienie bierne i terapia fagowa (García-Quintanilla et al., 2013).
kilka badań wykazało skuteczność biernej immunizacji u myszy przy użyciu przeciwciał specyficznych dla CPS, które chronią przed bakteryjnym wyzwaniem z 13-55% klinicznych izolatów A. baumannii (Russo et al., 2013; Yang i in., 2017; Lee et al., 2018)., Dodatkowo, szczepienie koniugowanymi szczepionkami zawierającymi glikany CPS przyłączone do nośnika białka wywołują lepszą ochronę immunologiczną niż oczyszczone CPS przeciwko różnorodnym szczepom A. baumannii (Yang et al., 2017).
zainteresowanie terapią fagową w leczeniu zakażeń bakteryjnych wzrosło w ostatnich latach w odpowiedzi na obecny kryzys rosnącej oporności na środki przeciwdrobnoustrojowe. Terapia fagowa jest atrakcyjna jako potencjalna droga leczenia zakażeń A. baumannii opornych na wiele leków., Na przykład, Fage kodujący depolimerazę CPS stwierdzono, że degraduje CPS około 10%, cztery z 38, kliniczne wielolekooporne A. baumannii testowane (Hernandez-Morales et al., 2018). Chociaż zasięg gospodarza tego faga jest ograniczony, może być włączony jako część koktajlu fagowego, aby zmaksymalizować skuteczność lub celować w określone ogniska (Hernandez-Morales et al., 2018). Fage, który selektywnie rozszczepia połączenie A., baumannii CPS na gałąź kwasu pseudaminowego może być cenne dla terapii fagowej, lub skutecznie produkować oczyszczone CPS dla szczepionki i rozwoju przeciwciał (Lee et al., 2018). Ostatnio wykazano, że Phage celujący A. baumannii jest stabilny, gdy jest impregnowany w produktach do pielęgnacji ran oparzeniowych w różnych warunkach, w tym w obecności środków przeciwdrobnoustrojowych (Merabiszvili et al., 2017). Ponieważ jednak większość badań nad A. baumannii CPS jest zwykle ograniczona do określonego szczepu A. baumannii, nie wiadomo, czy wyniki te przekładają się na wszystkie A., baumannii izoluje lub jeśli są specyficzne dla szczepu lub kapsułek. Zrozumienie, jakie role odgrywa kapsułka w wielu szczepach jest najważniejsze w identyfikacji typów CPS, które stanowią najlepsze cele dla nowych szczepionek, lub czy rozwój środków przeciwdrobnoustrojowych ukierunkowanych na szlak biosyntezy kapsułek jest rzeczywiście nawet wykonalne.
Uwagi końcowe
chociaż kapsułka reprezentuje ważną cechę zjadliwości A. baumannii, dostępne są ograniczone dane dotyczące roli różnych rodzajów CPS w wywoływaniu chorób., Aby opracować skuteczne szczepionki i terapie ukierunkowane na CPS, musimy najpierw uzyskać kompleksowe zrozumienie mechanizmów leżących za jego syntezą i ekspresją, wraz z zaletami, jakie kapsułka przekazuje bakteriom gospodarza. Badania te należy podjąć w kontekście skrajnej zmienności serotypów CPS stwierdzonych u A. baumannii, aby zapewnić potencjalne interwencje przeciwko szczepom produkującym różnorodne struktury CPS., Dalsze badania nad CPS są wymagane, aby zapewnić platformę dla rozwoju środków zapobiegawczych i metod leczenia przeciwko temu coraz bardziej uporczywemu i śmiertelnemu ludzkiemu patogenowi.
wkład autora
JS napisał pierwszy szkic. MB zapewniła wkład naukowy i krytyczną rewizję artykułu. FA wyprodukowała wyrównania genomu i zapewniła krytyczną rewizję rękopisu. Wszyscy autorzy zatwierdzili ostateczną wersję.
finansowanie
praca ta była wspierana przez Grant Fundacji Flinders Medical Research Foundation dla MB. FA była wspierana przez AJ i IM Naylon oraz Playford Trust Ph. D., Stypendia. JS był wspierany przez AJ i IM Naylon Scholarship.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone w przypadku braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Określenie serotypu Acinetobacter baumannii w celu określenia ognisk krzyżowego zakażenia szpitalnego. J. Clin. Mikrobiol. 27, 2713–2716.
PubMed Abstract | Google Scholar
, Biosynteza i montaż polisacharydów otoczkowych grupy 1 w Escherichia coli i pokrewnych polisacharydach pozakomórkowych w innych bakteriach. Węglowodany. Res. 338, 2491-2502. podoba mi się! do obserwowanych nr: 701662003.08.010
PubMed Abstract | CrossRef Full Text | Google Scholar
WHO (2017). Globalna priorytetowa lista bakterii odpornych na antybiotyki do prowadzenia badań, odkryć i rozwoju nowych antybiotyków. Genewa: Światowa Organizacja Zdrowia.
Google Scholar
