Wprowadzenie do grupy karbonylowej
w chemii organicznej Grupa karbonylowa jest grupą funkcyjną, w której atom węgla i tlenu jest połączony wiązaniem podwójnym. Związki zawierające grupę karbonylową są znane jako związki karbonylowe. Grupa karbonylowa odnosi się do tlenku węgla może również przyłączony do atomu nieorganicznego jako ligand, który jest nazywany karbonyl metalu, np. karbonyl niklu.,
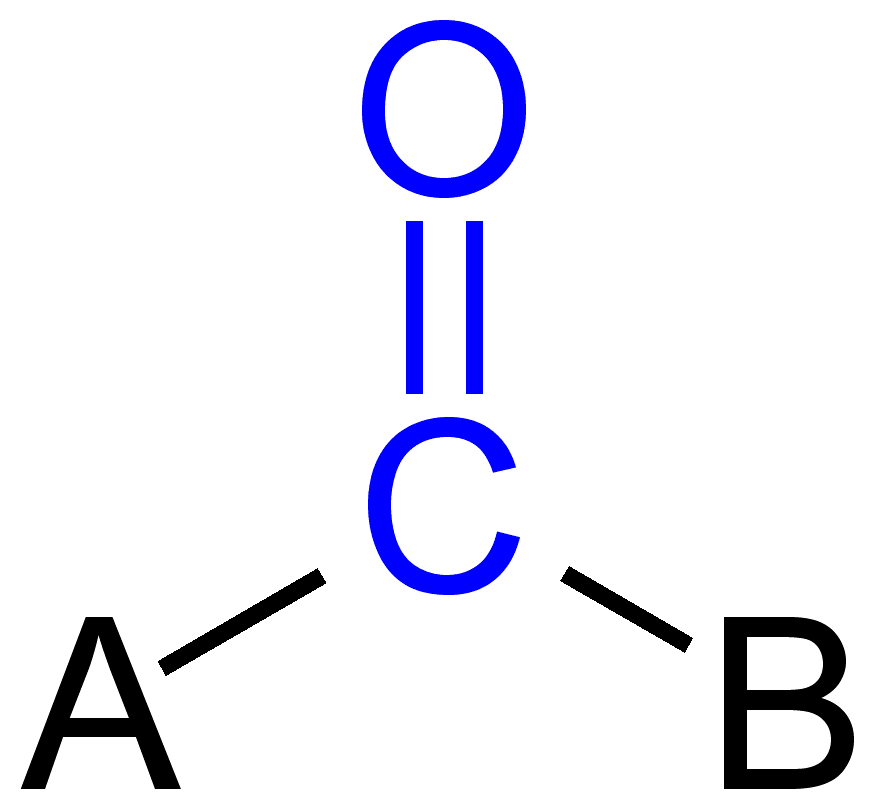
niektóre grupy karbonylowe
wiązanie podwójne w grupie karbonylowej
atom węgla i tlenu w grupie karbonylowej jest zwykle hybrydyzowany sp2, a tym samym plannar. Ze względu na obecność tlenu jako atomu elektronegatywnego wiązanie podwójne w grupie karbonylowej różni się od wiązania podwójnego w alkenach pod względem reaktywności. Z powodu większej elektroujemności i obecności dwóch samotnych par elektronów tlen staje się częściowo ujemnym ładunkiem, podczas gdy węgiel karbonylowy generuje częściowo dodatni ładunek i w ten sposób obserwuje się polaryzację.,
struktura rezonansu Karbonylowego
ze względu na obecność tlenu jako atomu elektronowego, Grupa karbonylowa wykazuje strukturę rezonansową. Struktura rezonansowa grupy karbonylowej wpływa na reaktywność związku. Bardziej elektronegatywny atom tlenu odciąga elektron od centrum węgla sprawia, że węgiel karbonylowy jest częściowo elektropozycyjny, a tlen częściowo elektronegatywny. W ten sposób polaryzacja generuje się wewnątrz związku karbonylowego.
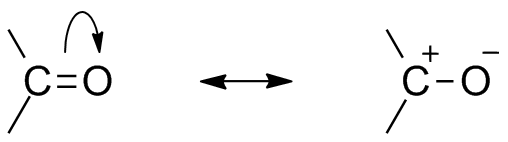
Ten elektropozyczny węgiel karbonylowy lub elektrofil może być teraz zaatakowany przez nukleofil.,
reaktywność
Alkilacja Karbonylowa
Alkilacja grupy karbonylowej w reakcji addycji nukleofilowej przy użyciu odczynnika Grignarda przedstawia się następująco:

Właściwości fizyczne związków karbonylowych
- temperatura wrzenia aldehydów i ketonów jest wyższa niż temperatura wrzenia.punkt eterów i alkanów o podobnej masie cząsteczkowej.
- ponownie temperatura wrzenia aldehydów i ketonów jest niższa niż odpowiadających im alkoholi.,
- wiele wyższych aldehydów ma przyjemny zapach i jest używanych w perfumach lub jako sztuczny aromat, podczas gdy niższy członek ich homologicznych serii ma ostry zapach.
- wyższe ketony mają mdły zapach, a niższe mają przyjemny zapach, taki jak aceton.
- Małe aldehydy i ketony są rozpuszczalne w wodzie, ale wraz ze wzrostem długości łańcucha zmniejsza się Rozpuszczalność.
- siły dyspersji van der Waalsa stają się silniejsze, gdy cząsteczki stają się dłuższe.,
Wiązanie H W goupie karbonylowej
ze względu na powstawanie wiązania H pomiędzy tlenem karbonylowym a Wodorem cząsteczki wody, niższe związki karbonylowe są rozpuszczalne w wodzie. Ale w miarę wzrostu łańcucha, przychodzi na drodze do tworzenia wiązania wodorowego i rozpuszczalność maleje.
Dipol Van der Waalsa-przyciąganie dipolowe
ze względu na polaryzację w grupie karbonylowej i obecność sił dyspersyjnych istnieje przyciąganie między dwiema pobliskimi cząsteczkami. Powoduje to, że temperatura wrzenia związków karbonylowych jest wyższa niż odpowiadających im alkanów., W poniższej tabeli należy zauważyć, że temperatura wrzenia związków karbonylowych jest wyższa niż odpowiadających im alkanów i niższa niż alkoholi.,v>Boiling point (o C)
Spectroscopy
Infrared spectroscopy
The absorption of carbonyl group depends on the geometry of the molecule., Zwykle absorpcja światła podczerwonego wykazuje przy liczbach falowych około 1600-1900 cm-1 (5263 nm do 6250 nm).
magnetyczny rezonans jądrowy
węgiel-NMR węgla karbonylowego wykazuje szczyt w przybliżeniu pomiędzy 160-220 ppm.
