notacja D i L dla konfiguracji bezwzględnej cukrów i aminokwasów
Co odróżnia „D – glukozę” od „L – glukozę” ? Albo D-alanina z L-alaniny?
a co to w ogóle za nazewnictwo D i L? Czytaj dalej:
spis treści
- D – I L – zapewniają szybki skrót do oznaczania enancjomerów
- dlaczego zawracamy sobie głowę tą starożytną nomenklaturą?,
- l – I D-System przypisywania „konfiguracji absolutnej”
- Czterowęglowe aldehydy D-I L – cukry (Aldotetrozy)
- Pięciowęglowe aldehydy D – I L-cukry (Aldopentozy)
- Sześciowęglowe aldehydy D – I L – cukry (Aldoheksozy)
- ale czekaj-jest więcej! (Aminokwasy)
- podsumowanie: D-I L-notacja dla cukrów i aminokwasów
- uwagi
- (zaawansowane) Referencje i dalsze czytanie
D – I L – zapewnia szybki skrót do oznaczania enancjomerów
d – i L – notacja zapewnia szybki skrót do oznaczania enancjomerów.,
D-glukoza jest enancjomerem np. L-glukozy. Ponieważ L-alanina jest enancjomerem D-alaniny.
jest on przypisany w następujący sposób. Dla cukru narysowanego w projekcji Fischera z najbardziej utlenionym węglem na górze (tj. aldehydem lub ketonem)
- jeśli OH na Dolnym chiralnym centrum wskazuje na prawo, to jest on określany jako D-
- jeśli OH na Dolnym chiralnym centrum wskazuje na lewo, jest określany jako L -.
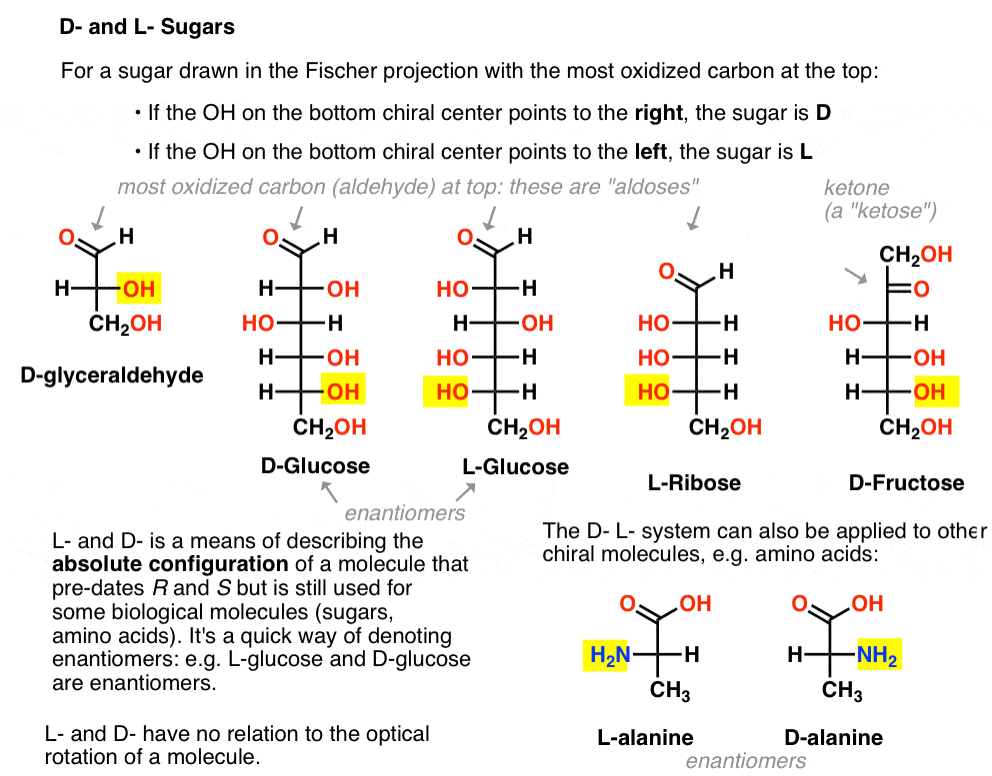
ta terminologia może być również stosowana do aminokwasów: patrz L – I D – alanina na powyższym zdjęciu.,
2. Dlaczego Zawracamy Sobie Głowę Tą Starożytną Nomenklaturą?
można by zapytać: czy nie mamy już systemu do przypisywania konfiguracji absolutnej ? Po co nam nowy system?
system D-L nie jest nowym systemem, ludzie. To stary system-wyprzedza Cahn-Ingold-Prelog.
system D-L jest dosłownie pozostałością epoki koni i wozów, sięgającej czasów prac Emila Fischera nad węglowodanami pod koniec XIX wieku – czasu, w którym chemicy organiczni nie mieli możliwości określenia absolutnej konfiguracji stereocenterów, co stało się możliwe dopiero w 1951 roku (thx, Bijvoet).,
więc dlaczego wciąż się używa? Czy nie powinien być wysłany do kosza historii, wraz z zasadami slajdów, 8-ścieżkowe kasety i dyskietki 5¼”?
dobrze, są kwitnące społeczności w częściach wiejskich Ameryki, gdzie utrzymują się powozy konne-jeśli wiesz, gdzie szukać. (Może kiedyś będą Gminy, w których ludzie korzystają tylko z technologii komputerowej z Lat 70. i 80.?)
podobnie jest w chemii organicznej, gdzie system D-L nadal znajduje zastosowanie, a to jest szczególnie w sferze cukrów i aminokwasów.,
to nie bunt amiszowskich chemików przeciwko współczesnemu złu systemu CIP. Istnieją co najmniej 3 dobre powody, w konkretnym przypadku cukrów i aminokwasów, do stosowania L – I D -:
- zwięzłość. D-glukoza jest o wiele szybsza do napisania i powiedzenia niż (2R,3S,4R, 5R)2,3,4,5,6-pentahydroksyheksanal. L -/D-system pozwala na konfigurację cząsteczki z wieloma centrami chiralnymi, którą można podsumować pojedynczą literą (plus jego potoczną nazwę, oczywiście – dzięki Noelowi za przypomnienie)
- więcej zwięzłości., Tak się składa, że jest to szybki sposób na odniesienie się do enancjomerów. Enancjomerem L-glukozy jest D-glukoza. Enancjomerem L-tryptofanu jest D-tryptofan. I chociaż możemy użyć ( + ) – lub ( – ) – prefiksy odróżnić dwa enancjomery glukozy i innych cukrów, znak optycznej rotacji może się różnić z rozpuszczalnika, temperatura, stężenie i inne czynniki, które sprawia, że mniej niż idealny. Dodatkowo, L-I D-odnoszą się konkretnie do konfiguracji absolutnej, podczas gdy (jak zauważyliśmy wcześniej) nie ma prostej zależności między znakiem obrotu optycznego a konfiguracją.,
- okazuje się, że większość naturalnie występujących cukrów to D -, a większość naturalnie występujących aminokwasów to L- . Istnieje ogromna ilość informacji skompresowanych w tym oświadczeniu i nie ma konkurencyjnego systemu (R / S,+/–), który mógłby zastąpić L – I D-pojedynczym znakiem. Uwaga
w przypadku cukrów i aminokwasów L – I D – mogą być użytecznymi oznaczeniami. W przypadku innych cząsteczek można w dużej mierze o tym zapomnieć.
czym jest ten D-/L – system i jak te terminy odnoszą się do struktury?,
Dołącz do mnie, gdy cofamy się w czasie…
L – I D – System do przypisywania „konfiguracji absolutnej”
Emil Fischer rozpoczął badania węglowodanów w późnych latach 1880-tych. do tego czasu (za pośrednictwem Van ' t Hoffa) było wiadomo, że węgiel jest czworościenny, a także wiadomo, że cząsteczki zawierające węgiel z czterema różnymi podstawnikami mogą obracać się w płaszczyźnie spolaryzowanego światła (np. Pasteur). To, czego nie było znane, to absolutna konfiguracja którejkolwiek z chiralnych cząsteczek – co dziś nazywamy ich konfiguracjami „R” I „S”.,
najprostszym węglowodanem zawierającym chiralny ośrodek jest aldehyd glicerolowy, C3H6O3. Aldehyd glicerolowy ma trzy węgle, co czyni go „triozą”. Najbardziej utlenionym węglem w aldehydie glicerolu jest aldehyd, który również czyni go „aldozą”.
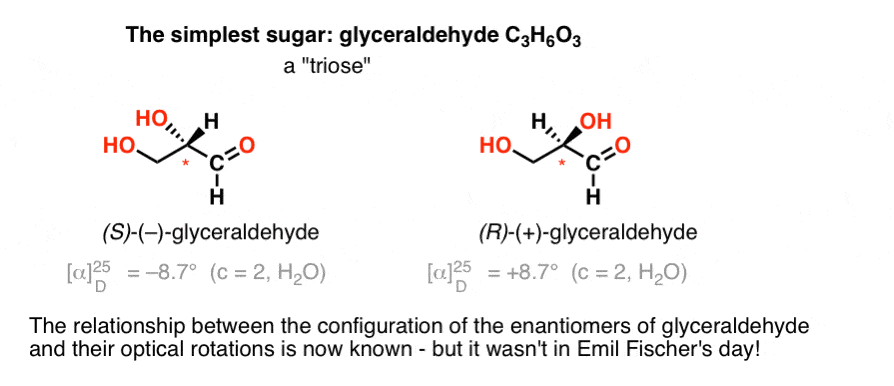
w 1888 roku wyizolowano i scharakteryzowano dwa enancjomery aldehydu glicerolowego., Ale ponieważ nie ma prostej korelacji między konfiguracją ośrodka chiralnego a kierunkiem, w którym obraca się on w płaszczyźnie spolaryzowanego światła, Emil Fischer nie miał możliwości związania optycznego obrotu ( + )-i ( – ) –glicerolu z absolutną konfiguracją atomów wokół ośrodka chiralnego.
używając dzisiejszej terminologii nie wiedział, czy (–)-glicerol był (R) Czy (S).
,
zgadywanie, które okazało się poprawne, było takie, że (–)-gliceroaldehyd ma konfigurację, którą teraz nazywamy S, i że (+)-gliceroaldehyd ma konfigurację, którą teraz nazywamy R.
oczywiście Cahn, Ingold i Prelog jeszcze się nie urodzili, a system CIP zostanie opracowany dopiero po pracy Bijvoeta w 1951 roku. Fischer opracował więc własną nomenklaturę.
rysując gliceroaldehyd w tym, co później nazwano projekcją Fischera, przypisał konfigurację po lewej stronie na ( – ) – gliceroaldehyd i nazwał ją L – (skrót od łacińskiego laevo )., Następnie przypisał konfigurację na prawo do (+)- glicerolu i nazwał ją D- (z łac. dextro ).
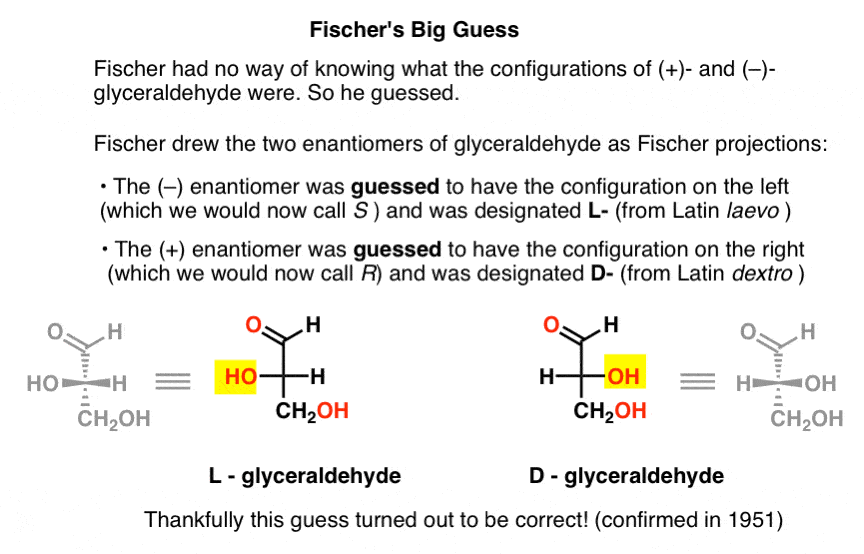
Dlaczego jest to takie ważne?
przypisanie konfiguracji absolutnej dla L – I D – glicerolu było trochę jak przypisanie południka pierwszego (0° długości geograficznej) do Królewskiego Obserwatorium w Greenwich w Anglii., Podobnie jak Długość geograficzna każdego innego miejsca na Ziemi może być określona względem tego punktu, jeśli ich względne odległości były znane, konfiguracja absolutna każdego innego stereocentrum może być określona, jeśli jego konfiguracja względem L – lub D – glicerolu była znana.
To może nie być najjaśniejsza analogia. Spójrzmy więc na cukry 4-węglowe dla innego przykładu.,
cztery D – I L – cukry aldehydu Węglowego (Aldotetrozy)
po zaproponowaniu absolutnych konfiguracji L – I d – glicerolu, można było ustalić absolutne konfiguracje innych związków chiralnych przez analogię (i wiele prac chemicznych).
nie jest to istotne na dziś, ale przykład takiego rozumowania można znaleźć tutaj.
Kiedy wprowadzano pojęcie centrów chiralnych, prawdopodobnie dowiedziałeś się, że cząsteczka z N centrami chiralnymi będzie miała stereoizomery 2n (o ile nie ma związków mezo).,
istnieją dwie czterodrogowe aldozy, trójroza i erytroza. Każdy z nich posiada dwa ośrodki chiralne. Każdy z nich istnieje jako para enancjomerów (L – I D -), dając w sumie cztery stereoizomery.
oto one. Ważną rzeczą, którą należy zauważyć na poniższym rysunku, jest to, że rodzina cukrów L ma grupę OH dolnego chiralnego węgla po lewej stronie, a rodzina D ma grupę OH dolnego chiralnego węgla po prawej stronie (podświetlone).,
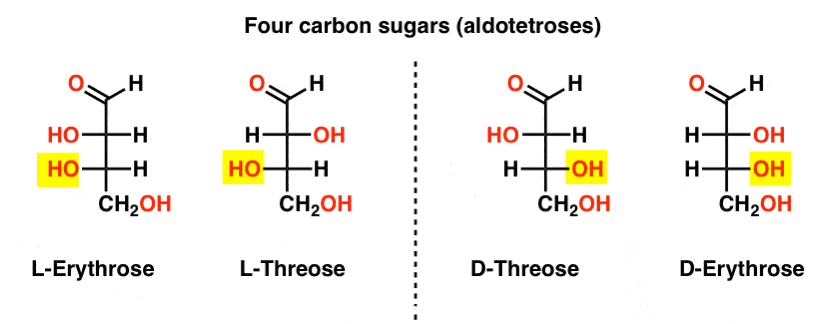
zobacz, jak L-erytroza i L-Treoza budują się na stereocentrze utworzonym w L-glicerolu (podświetlonym), A D-erytroza i D-Treoza budują się na stereocentrze utworzonym w D-glicerolu (podświetlonym).
cukry są zbudowane trochę jak system binarny; można myśleć, że każdy stereocenter jest „bitem”, który może mieć jedną z dwóch wartości. Konfiguracja l-erythrose i L-threose różni się tylko w jednym stereocentrum. Gdybyśmy przewrócili pozycję H I OH, dostalibyśmy drugą., Związek ten ma nazwę, którą czasami można zobaczyć: dwie cząsteczki, które mają przeciwną konfigurację w jednym stereocentrum, nazywane są epimerami, szczególnie gdy jednym z atomów przyłączonych do stereocentrum jest wodór (H).
pięć aldehydów węglowych D – I L – cukrów (Aldopentozy)
najbardziej znaną nazwą na tej liście powinna być ryboza, która jest trzonem cukrowym kwasu rybonukleinowego (RNA).
po lewej stronie na poniższym diagramie mamy l-aldopentozy, które wszystkie mają tę samą konfigurację dolnego stereocentru, gdy aldehyd jest umieszczony na górze.,
ich enancjomery, d-aldopentozy, znajdują się po prawej stronie, wszystkie mają tę samą konfigurację dolnego stereocentrum (podświetlone).
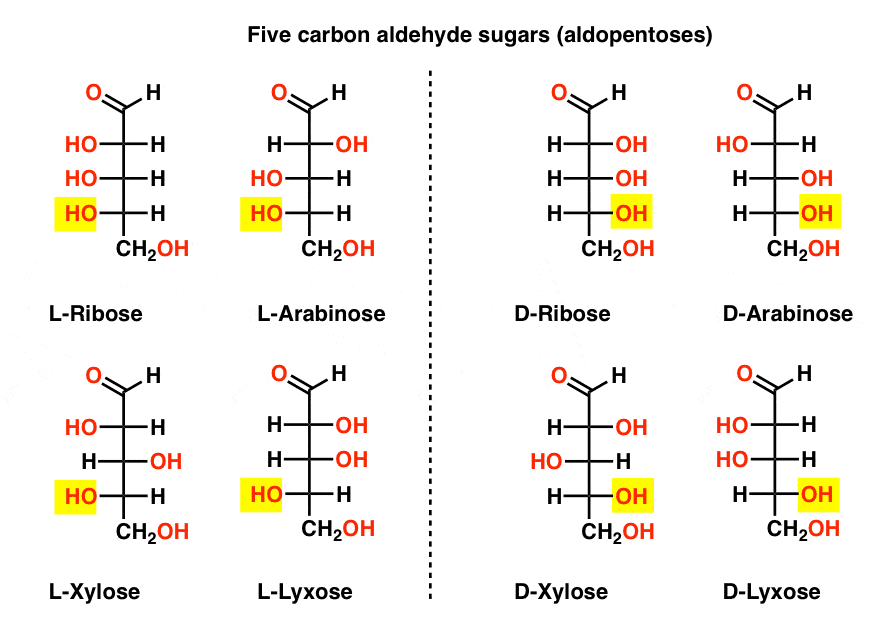
w tym miejscu powinniśmy zwrócić uwagę, że przeważająca większość cukrów w ziemskich formach życia to cukry D, w tym D-ryboza jako szkielet RNA. Dlaczego i jak wszystkie organizmy na ziemi skończyły z D-cukrami jest tajemnicą, ponieważ zakłada się, że L-cukry zadziałałyby równie dobrze.,
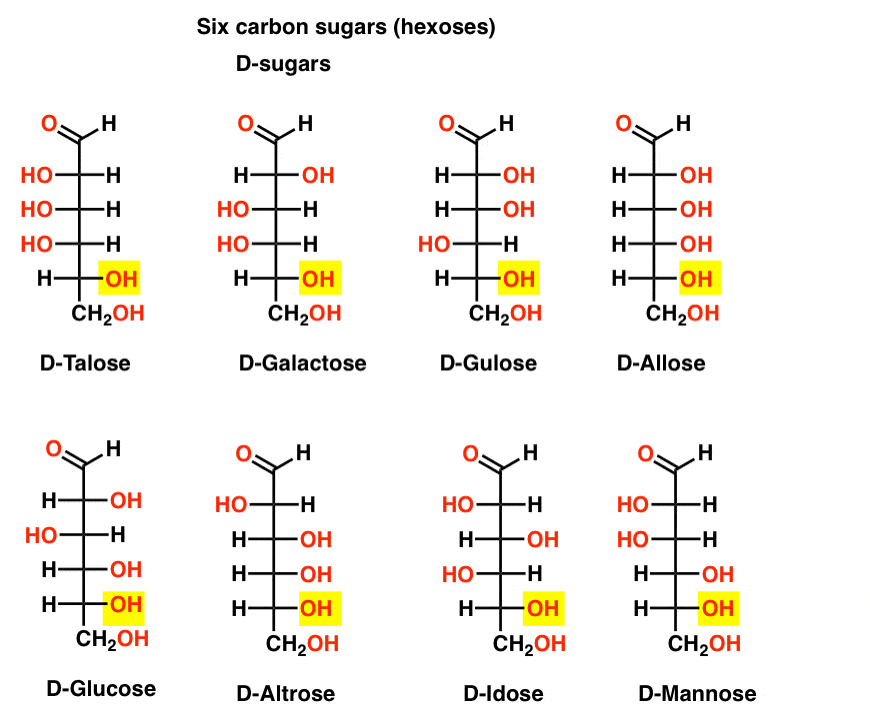
sześć aldehydów węglowych D – I L – cukrów (Aldoheksozy)
Jeśli są 4 aldopentozy, każda jako D – L – para enancjomerów (łącznie 8 stereoizomerów), to ile jest Aldoheksoz?
jest 8 par D-L (łącznie 16 stereoizomerów). Najbardziej znana jest glukoza, ale prawdopodobnie rozpoznasz mannozę i galaktozę. Niektóre są rzadko, jeśli w ogóle, spotykane w przyrodzie(idose, anyone?).
oto d-aldoheksozy. Zauważ, że wszystkie mają tę samą konfigurację dolnego centrum chiralnego – tę samą, którą widzieliśmy w D-glicerolu.,
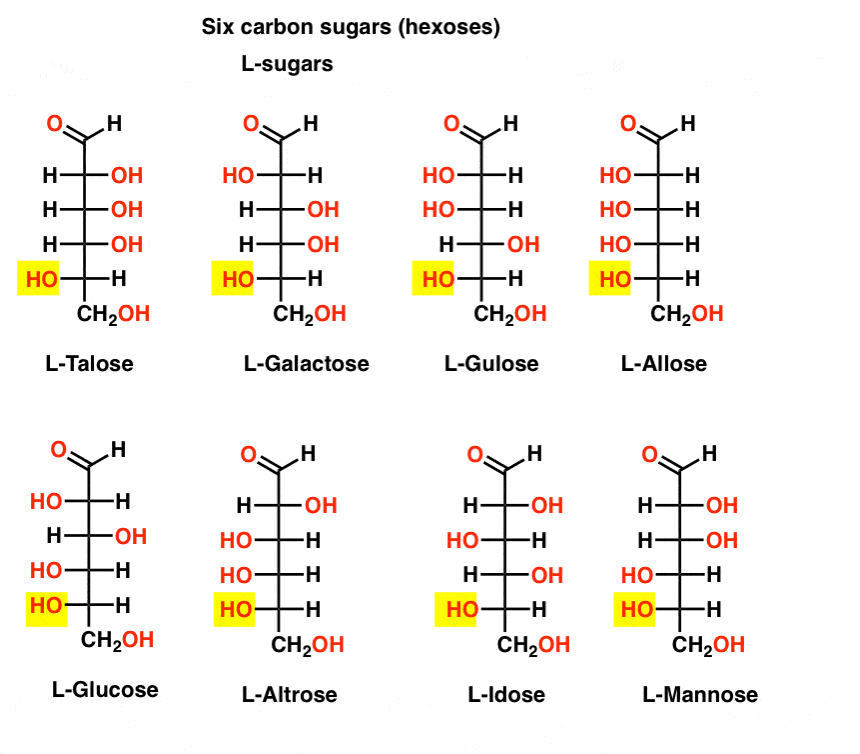
w przeciwieństwie do D-cukrów, l – cukry (poniżej) są rzadko spotykane w przyrodzie. Co ciekawe, l-glukoza została zbadana jako substytut cukru. Jego smak jest nieodróżnialny od naturalnie występującej D-glukozy, ale nie dostarcza pożywienia, ponieważ nie może być rozkładany przez nasze (chiralne) enzymy. Jak się okazuje produkcja jest po prostu zbyt droga, aby konkurować ze Splendą, stewią, aspartamem i innymi. al.
OK, wystarczy. Powstały cukry siedmiowęglowe (aldoheptozy), ale nie mają znaczenia biologicznego.,
7. Ale czekaj – to nie wszystko! (Aminokwasy)
jeśli narysujesz aminokwasy w rzucie Fischera z najbardziej utlenioną grupą na górze (kwasem karboksylowym) to możesz również przypisać L-I D -.
z 19 chiralnych aminokwasów, które są włączone do białek (proteinogenne jest właściwe określenie) to wszystkie L- . (Glicyna jest achiralna, więc D-i L – nie mają zastosowania). Niektóre d-aminokwasy występują naturalnie, ale są rzadkie (występują głównie u bakterii, z zauważalnym wyjątkiem jadu dziobaka) i nie są kodowane przez mRNA.,
Co ciekawe, chociaż wszystkie 19 aminokwasów chiralnych to L- , tylko 18 z 19 to (S). Co to za wyjątek?
(to dobre ciekawostki z chemii organicznej).
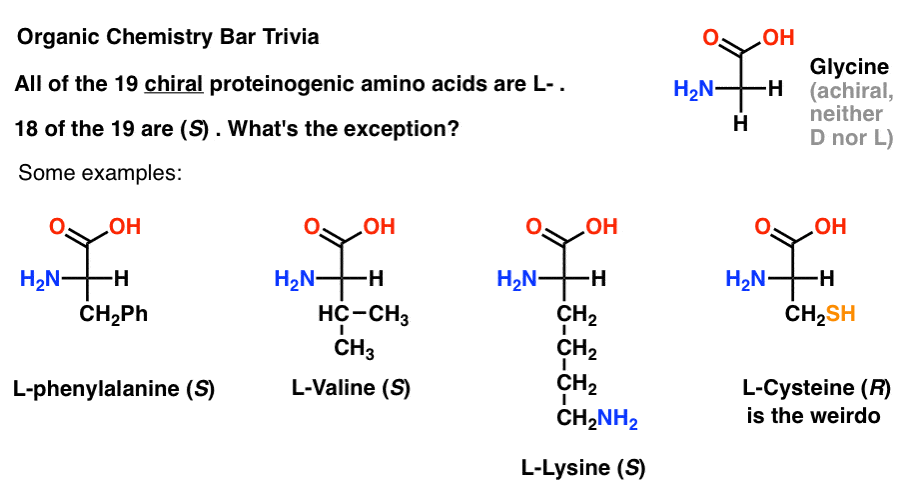
Cysteina jest dziwakiem.
(Bonus points if you also said selenocysteine … nerd).
podsumowanie: D – I L – notacja dla cukrów i aminokwasów
czyli układ D-L do przypisania konfiguracji absolutnej. To działa dobrze dla cukrów, ponieważ mogą one być budowane tak systematycznie (jak system binarny). Jest również przydatny dla aminokwasów., Kluczowym punktem jest tylko spojrzenie na dolne stereocentrum, gdy jest narysowane w projekcji Fischera. Prawda? / Align = „Left” / L.
oczywiście cukry nie zawsze są tak pomocnie rysowane w rzutach Fischera-tworzą pierścienie. O oznaczaniu D – I L – w cukrach cyklicznych napiszemy w przyszłym poście.
jedyne co mam do powiedzenia to to, że dzięki temu, w co wierzysz, zgadywanie Fischera okazało się słuszne. Byłoby ogromnym wrzodem na dupie przesiać przez 70 + lat literatury chemicznej wiedząc, że niewłaściwa konfiguracja została przypisana do wszystkich cukrów i aminokwasów.,
podziękowania dla Thomasa Struble ' a za pomoc przy tym poście.
uwagi
Uwaga 1. „przedostatnim stereocenterem w większości chiralnych cukrów jest R, podczas gdy stereocenterem w większości aminokwasów jest S” nie ma zupełnie tego samego Pierścienia, zwłaszcza, że cysteina to R.]
Uwaga. Oto eksperyment myślowy do określenia względnych konfiguracji erytrocytów i trójrozy., (Mówię „eksperyment myślowy”, ponieważ nie chcę włączać konkretnych odczynników, które mogłyby rozpraszać)
Jeśli zaczyna się od czystego (+)-erythrose i utlenia alkohol pierwotny do aldehydu za pomocą znanych metod, uzyskuje się związek bez żadnej rotacji optycznej. To samo dotyczy ( – ) – erytrocytów, które zwracają całkowicie identyczny związek. Z tego można wywnioskować, że struktura nowego związku musi być taka, aby cząsteczka miała wewnętrzną płaszczyznę zwierciadlaną (tzn. jest to mezo). .,
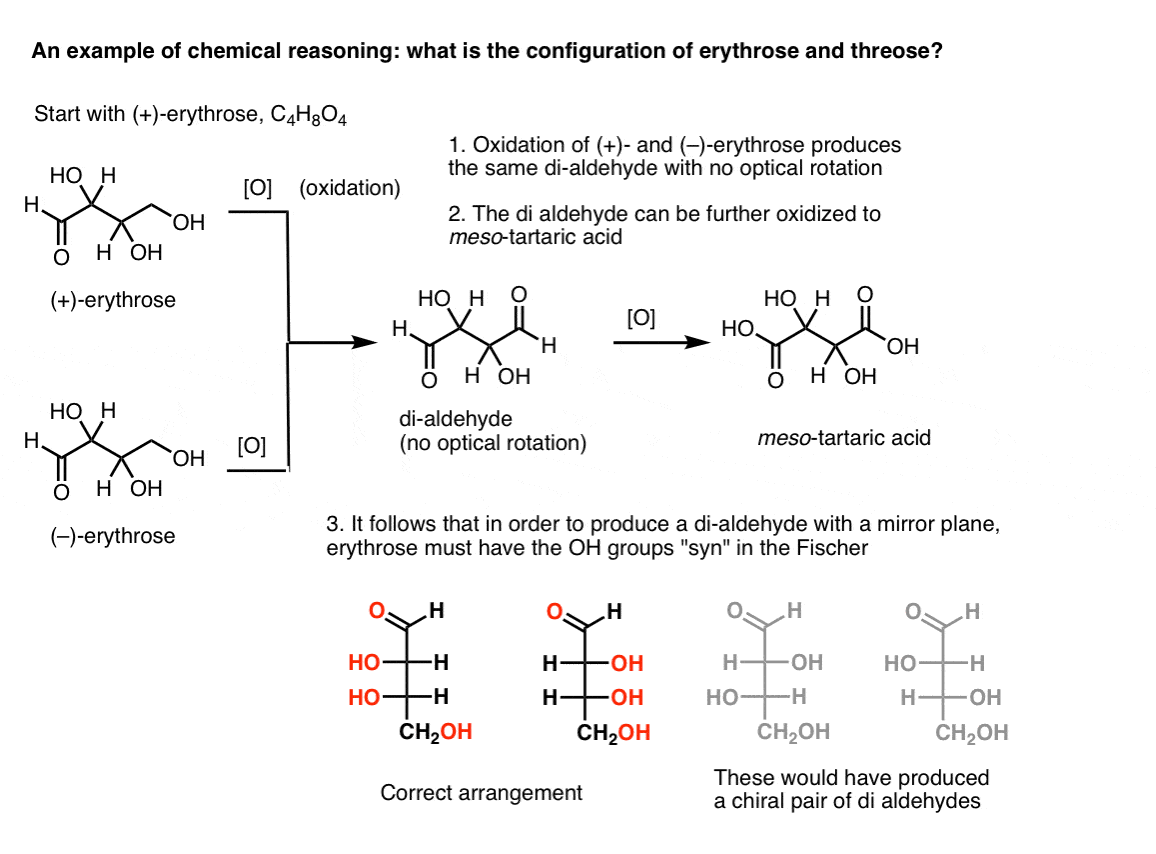
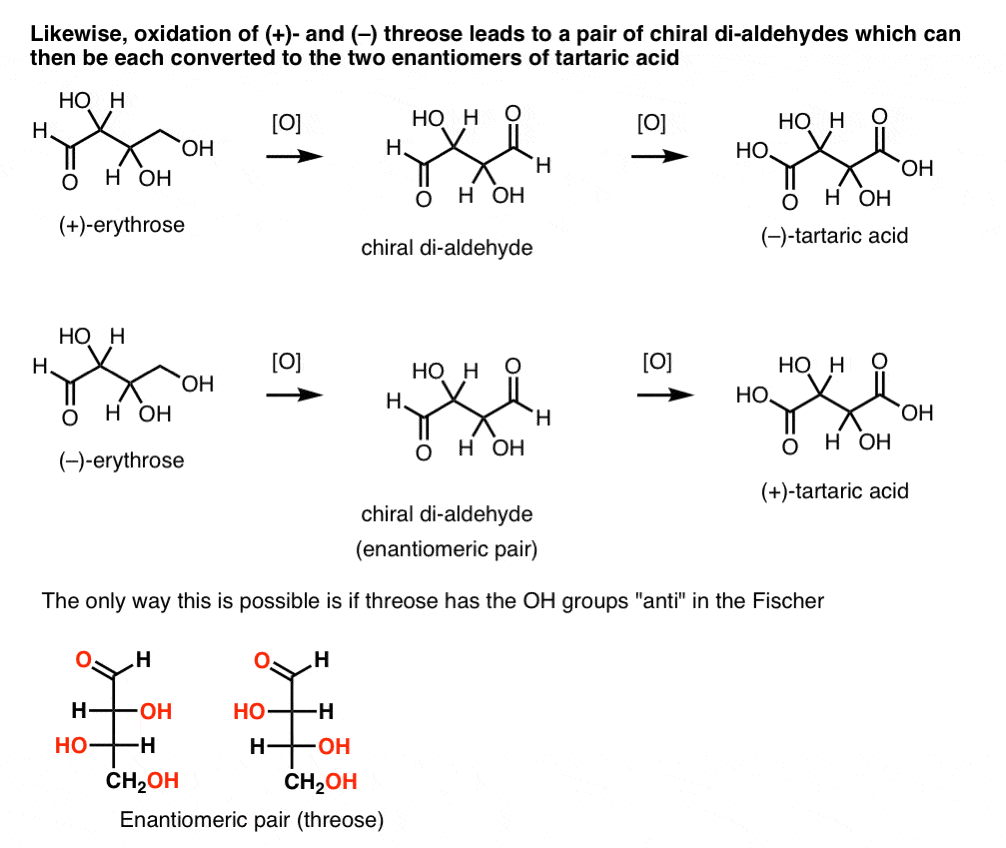
w przeciwieństwie do tego, wykonanie tej samej operacji na (+)-threose powoduje powstanie di-aldehydu, który utrzymuje rotację optyczną. Związek o równej i przeciwnej rotacji optycznej powstaje przez wykonanie tej samej operacji na ( – ) – threose. Te dwa związki są enancjomerami. Aby to było prawdziwe, względna orientacja grup hydroksylowych w treozie musi być anty. Związki te mogą być dalej utleniane w celu wytworzenia odpowiednio kwasu ( – ) – i ( + ) – winowego.,
to samo rozumowanie może być użyte w przeciwnym kierunku (redukcja). Na przykład albo (+)- albo (–)- erytrytol można zredukować do erytrytolu tetra-ol, czyli mezo.
podobnie, redukcja (+)- i (–) threose powoduje powstanie enancjomerycznej pary tetra-ols, threitol.
z tych faktów możemy wywnioskować względną orientację grup OH.
(Advanced) reference and Further Reading
- Über die Bezeichnung von optischen Antipoden durch die Buchstaben d und l
Emil Fischer
Ber. 1907, 40 (1), 102-106
DOI: 10.,1002 / cber.19070400111
jest to słynna gazeta, w której Prof. Emil Fischer (pol.).) przypisano ( – ) – glicerolu l-stereochemii. - syntezy w grupie puryn i cukru
Emil Fischer
Nobel Lecture, 1902Nobel Lecture Fischera, gdzie opowiada o swojej pracy nie tylko w węglowodanach, ale także w purynach, których związki takie jak kofeina i teobromina są członkami. Prof. Fisher przewiduje wzrost napojów energetycznych (np., Red Bull), stwierdzając: „przy odrobinie wyobraźni można przewidzieć dzień, w którym ziarna nie będą już potrzebne do przygotowania dobrej kawy: niewielka ilość proszku z substancji chemicznej wraz z wodą zapewni pikantny, orzeźwiający napój zaskakująco tanio”.
- wyznaczanie konfiguracji bezwzględnej związków optycznie czynnych za pomocą promieni rentgenowskich
BIJVOET, J., PEERDEMAN ,A. & van BOMMEL, A.,
Nature 1951, 168, 271-272
Doi: 1038/168271a0
słynna praca, która udowodniła, używając rentgenowskiej analizy strukturalnej, że „konwencja Emila Fischera, która przypisała konfigurację rys. 2 do kwasu dekstrorotacyjnego, wydaje się odpowiadać rzeczywistości”. - odkrycie konfiguracji glukozy przez Emila Fischera. A semicentennial retrospect
C. S. Hudson
Journal of Chemical Education 1941, 18 (8), 353
Doi: 10.1021/ed018p353
wczesny przegląd, który obejmuje prace prof. Emila Fischera w chemii węglowodanów., - Emil Fischer ' s Proof of the Configuration of Sugars: a Centennial Tribute
Frieder W. Lichtenthaler
Angew. Chem. Int. Ed. 1992, 31 (12), 1541-1556
DOI: 10.1002/ania.199215413
bardzo czytelna recenzja z 1992 roku, która obejmuje prace Prof. Fischera w chemii węglowodanów i dogłębnie bada stereochemiczne przypisania węglowodanów.
