przykład – Przewidywanie polaryzacji molekularnej:
decyduje, czy cząsteczki reprezentowane przez następujące wzory są polarne lub polarne. (Może być konieczne narysowanie struktur Lewisa i szkiców geometrycznych do doso.)
a. CO2 b. OF2 c. CCl4 d. CH2Cl2 e. HCN
rozwiązanie:
a. struktura Lewis dla CO2 jest

ELEKTROENERGETYCZNOŚĆ węgla i tlenu wynosi 2,55 i 3,44. 0.,89 różnica w elektroujemności wskazuje, że wiązania tec-O są polarne, ale symetryczny układ tych wiązań sprawia, że cząsteczka jest niepolarna.
jeśli umieścimy strzałki w geometrycznym szkicu dla CO2, zobaczymy, że dokładnie równoważą się, zarówno w kierunku, jak iwagnit. To pokazuje symetrię wiązań.
b., Struktura Lewisa dla OF2 jest
elektroenergetyczność tlenu i fluoru,odpowiednio 3,44 i 3,98, wytwarza różnicę 0,54, która prowadzi do przewidywania, że wiązania O-F są polarne. Geometria molekularna OF2 jest wygięta. Suchan asymetryczny rozkład wiązań polarnych wytworzyłby cząsteczkę polarną.
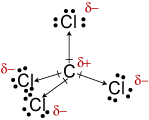
c. , Mimo że wiązania C-Cl są polarne, ich symetryczny układ sprawia, że cząsteczka jest niepolarna.
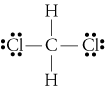
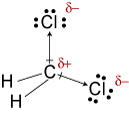
d. struktura CH2Cl2 jest
elektroenergetyczność wodoru, węgla i chloryny wynosi 2,20, 2,55 i 3,16. Różnica 0,35 W elektroujemności dla wiązań H-C mówi nam, że są one zasadniczo niepolarne. 0.,61rozmiar elektroenergetyki dla wiązań C-Cl pokazuje, że są one polarne. Poniższe szkice geometryczne pokazują, że wiązania polarne sąsymetrycznie ułożone, więc cząsteczka jest polarna. (Zauważ, że powyższa Lewistruktura błędnie sugeruje, że wiązania są symetrycznie ułożone.Należy pamiętać, że struktury Lewisa często dają fałszywe wrażenie geometrii cząsteczek, które reprezentują.)

e., Struktura i szkic geometryczny HCN są takie same:
elektroenergetyczność wodoru,węgla i azotu wynosi 2,20, 2,55 i 3,04. Różnica 0,35 W elektroenergetyczności dla wiązania H-C pokazuje, że jest ono zasadniczo niepolarne. Różnica 0,49 w elektroujemności wiązania C-N mówi nam, że jest ono polarne.Cząsteczki z jednym wiązaniem polarnym są zawsze polarne.