Trifluorek azotu właściwości chemiczne,zastosowania,produkcja
opis
trifluorek azotu jest bezbarwnym gazem o niewielkim zapachu. Trifluorek azotu jest utleniaczem, który jest następnie stabilny wododynamicznie, z wyjątkiem podwyższonych temperatur. W temperaturze do około 482°F (250 ° C) jego reaktywność jest porównywalna do tlenu. W wyższych temperaturach jego reaktywność jest podobna do fluoru ze względu na znaczną dysocjację na NF2 i F -., Dysocjacja trifluorku azotu była badana przez wielu badaczy i stwierdzono, że osiąga szczyt w zakresie temperatur od 1100k do 1500k. w obsłudze trifluorku azotu należy unikać warunków, które mogą powodować wysokie temperatury, takie jak adiabatyczne sprężanie z szybkiego zwiększania ciśnienia w systemie.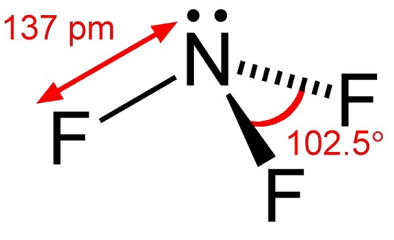
trifluorek azotu działa głównie na pierwiastki jako czynnik fluorujący, ale nie jest bardzo aktywny w niższych temperaturach., W podwyższonych temperaturach trifluorek azotu pirolizuje się z wieloma pierwiastkami w celu wytworzenia tetrafluorku azotu i odpowiadającego mu fluoru. Piroliza trifluorku azotu przez wióry miedzi wytwarza tetrafluorek azotu w wydajności od 62 do 71 procent w temperaturze 707 ° F (375°C). Piroliza nad węglem jest bardziej kompletna.
właściwości chemiczne
trifluorek azotu jest gazem bezbarwnym. Moldyodor. Dostarczany jako sprężony gaz.
właściwości fizyczne
bezbarwny gaz; spleśniały zapach; upłynnia się w temperaturze -128,75°C; gęstość cieczy 3.,116 g / mL; Ciśnienie pary w temperaturze -158°C 96 torr; krzepnie w temperaturze -206,8°C; temperatura krytyczna -39,15 ° C; ciśnienie krytyczne 44,02 atm; objętość krytyczna 126 cm3 / mol; bardzo słabo rozpuszczalny w wodzie.
zastosowanie
trifluorek azotu jest środkiem do wytrawiania i czyszczenia komory.
utleniacz do paliw wysokoenergetycznych, synteza chemiczna.
wykorzystuje
trifluorek azotu jest gazem, który składa się z atomów azotu i fluoru., Globalny przemysł elektroniczny wykorzystuje trifluorek azotu w swoich procesach czyszczenia, ponieważ gaz ten przewyższa inne alternatywy, jest łatwiejszy i bezpieczniejszy w obsłudze oraz pomaga zmniejszyć emisję gazów cieplarnianych.
producenci półprzewodników, cienkowarstwowych ogniw słonecznych i płaskich wyświetlaczy wykorzystują trifluorek azotu do czyszczenia komór procesowych. Wewnątrz komór na płytki i panele nakładane są cienkie warstwy półprzewodnikowych i izolacyjnych folii., Trifluorek azotu usuwa pozostałości, które te folie pozostawiają na ściankach komory, dzięki czemu komory mogą działać wydajnie i wytwarzać wysokiej jakości urządzenia.
trifluorek azotu oferuje wiele korzyści w porównaniu z alternatywnymi środkami czyszczącymi. Jest stabilny w temperaturze pokojowej, więc jest stosunkowo łatwy i bezpieczny w obsłudze. Łatwo jest również użyć trifluorku azotu do utworzenia energetycznego lub reaktywnego gazu lub plazmy-gazu z wolnymi elektronami. Stosunkowo długa żywotność rodników fluoru wytwarzanych w osoczu sprawia, że trifluorek azotu jest wydajnym środkiem czyszczącym.,
zastosowania
trifluorek azotu jest z powodzeniem stosowany w dużych ilościach jako źródło fluoru do laserów chemicznych o wysokiej energii. Jest preferowany ze względu na łatwość obsługi w warunkach otoczenia.
Ostatnio coraz większa ilość nitrogentrifluorku jest wykorzystywana w przemyśle półprzewodnikowym jako suchy wytrawiacz, wykazując znacznie wyższe tempo wytrawiania i selektywność w porównaniu z tetrafluorkiem węgla i mieszaninami tetrafluorku węgla i tlenu.,
trifluorek azotu był również stosowany jako utleniacz w rakietnictwie na początku lat 60. XX wieku, jednak nie został on komercjalizowany.
preparat
trifluorek azotu jest wytwarzany przez elektrolizę stopionego fluorku amonu, NH4F lub stopionego fluorku kwasu amonowego, NH4HF2 (lub fluorku amonu w bezwodnym HF). Podczas gdy metoda NH4F jest preferowana, ponieważ tworzy trifluorek azotu jako jedyny produkt, elektroliza fluorku kwasu amonowego daje niewielką ilość difluorku dinitrogenu, N2F2 i NF3.,
również trifluorek azotu można wytworzyć w reakcji amoniaku z fluorem rozcieńczonym azotem w reaktorze wypełnionym miedzią. Produkowane są również inne fluorki azotu, takie jak N2F2, N2F4 i NHF2. Wydajność głównego produktu zależy od stosunku fluoru / amoniaku i innych warunków.
metody produkcji
trifluorek azotu może powstawać w wyniku wielu różnych reakcji chemicznych. Komercyjny proces produkcji polega na bezpośredniej fluoryzacji amoniaku gazem fluorowym w obecności fluorku amonu.,
reakcje
Wodór reaguje z trifluorkiem azotu z szybkim uwalnianiem dużych ilości ciepła i jest podstawą zastosowania trifluorku azotu w wysokoenergetycznych laserach chemicznych. Zakres palności dla mieszanin trifluorku azotu z wodorem wynosi od 9,4 mol do 95 mol procent trifluorku azotu. Trifluorek azotu reaguje ze związkami organicznymi, ale zazwyczaj do rozpoczęcia reakcji wymagana jest podwyższona temperatura., W tych warunkach reakcja będzie często przebiegać wybuchowo i należy zachować szczególną ostrożność podczas wystawiania trifluorku azotu na działanie związków organicznych. Dlatego trifluorek azotu znalazł niewielkie zastosowanie jako czynnik fluorujący dla związków organicznych.
Opis ogólny
bezbarwny gaz o spleśniałym zapachu. Działa bardzo toksycznie przez drogi oddechowe. Słabo rozpuszczalny w wodzie. Działa żrąco na tkanki. W przypadku długotrwałego narażenia na ogień lub ciepło pojemniki mogą pęknąć gwałtownie i rakieta. Używany do produkcji innych chemikaliów oraz jako składnik paliw rakietowych.,
powietrze& reakcje wody
słabo rozpuszczalne w wodzie.
profil reaktywności
trifluorek azotu jest bardzo silnym środkiem utleniającym. Stwarza niebezpieczne zagrożenie pożarowe w obecności środków redukujących. Wytrawia szkło w obecności wilgoci. Po podgrzaniu do rozkładu emituje toksyczne i żrące opary fluoru . Może reagować gwałtownie z wodorem, amoniakiem, tlenkiem węgla, diboranem, siarkowodorem, metanem, tetrafluorohydrazyną, węglem drzewnym. Wybuchowa reakcja z dwutlenkiem chloru., Silny wybuch może wystąpić pod wpływem czynników redukujących pod ciśnieniem .
Zagrożenie
poważne zagrożenie wybuchem. Działa żrąco na tkanki. Methemoglobinemia, uszkodzenie wątroby i nerek.
zagrożenie dla zdrowia
wdychanie trifluorku azotu może zmniejszyć zdolność czerwonych krwinek do przenoszenia tlenu. Powoduje to sinicę lub niebieskawe przebarwienia skóry. Oddychanie trifluorkiem azotu może również prowadzić do bólu głowy, zawrotów głowy, osłabienia i dezorientacji., Po długotrwałym narażeniu na wysokie stężenia mogą wystąpić rozpad krwinek czerwonych i zmiany w wątrobie, nerkach, śledzionie i mięśniu sercowym jako działania drugorzędowe. Na świeżym powietrzu początkowe zmiany krwinek czerwonych ustępują w ciągu kilku godzin, ale osoba powinna być nadal monitorowana pod kątem wtórnych efektów.
zagrożenie pożarowe
substancja nie pali się, ale wspomaga spalanie. Niektóre mogą reagować wybuchowo z paliwami. Może zapalić materiały palne (drewno, papier, olej, odzież itp.). Opary skroplonego gazu są początkowo cięższe od powietrza i rozprzestrzeniają się wzdłuż ziemi., Spływ może powodować zagrożenie pożarem lub wybuchem. Pojemniki mogą eksplodować po podgrzaniu. Pęknięte cylindry mogą pękać.
zastosowania przemysłowe
trifluorek azotu jest z powodzeniem stosowany w dużych ilościach jako źródło fluoru do wysokoenergetycznych laserów chemicznych. Jest on preferowany w stosunku do fluoru ze względu na jego porównywalną łatwość obsługi w warunkach otoczenia.,
Ostatnio coraz większa ilość trifluorku azotu jest wykorzystywana w przemyśle półprzewodnikowym jako suchy wytrawiacz, wykazując znacznie wyższe szybkości wytrawiania i selektywności w porównaniu z tetrafluorkiem węgla i mieszaninami tetrafluorku węgla i tlenu.
trifluorek azotu był również stosowany jako utleniacz w rocketry we wczesnych latach 60. XX wieku, jednak zastosowanie to nie zostało skomercjalizowane.
materiały wykorzystuje
w temperaturach poniżej 482°F (250°C), trifluorek azotu ma reaktywność podobną do tlenku i jest stosunkowo obojętny do większości materiałów budowlanych., W temperaturach otoczenia mosiądz, aluminium, miedź, stal i stale nierdzewne mogą być używane, ponieważ wskaźniki korozji są mniejsze niż 0,1 mil/rok. w temperaturze 160°F (71,1 ° C) zostały określone dla tych materiałów. Trifluorek azotu jest również zgodny z materiałami fluorowanymi, takimi jak asTeflon w otoczeniu temperatures.At podwyższone temperatury i ciśnienia, reaktywność trifluorku azotu wzrasta, stając się bardziej podobny do fluoru, a nikiel i Monel są preferowanymi materiałami konstrukcyjnymi.
profil bezpieczeństwa
a poison. Lekko toksyczny przez wdychanie., Długotrwałe wchłanianie może powodować mottling zębów, zmiany szkieletowe.Poważne zagrożenie wybuchem przez chemicalreaction ze środkami redukującymi, szczególnie gdy pod ciśnieniem. Bardzo groźny pożar; bardzo silny utleniacz; w innym przypadku działa w normalnych temperaturach i ciśnieniach.
potencjalna ekspozycja
materiał ten był wykorzystywany w chemikalsyntezie oraz jako utleniacz paliw wysokoenergetycznych (utleniacz asan w kombinacjach paliw rakietowych).
efekty fizjologiczne
ACGIH, TheTLV-TWA to ważona czasowo średnia koncentracja dla nonnal 8-godzinnego dnia pracy i 40-godzinnego tygodnia pracy, na które prawie wszyscy pracownicy mogą być wielokrotnie narażeni, dzień po dniu, bez negatywnego wpływu.
OSHA wymienia 8-godzinną średnią dopuszczalną ekspozycję na Trifluorek azotu (TWA-PEL)na poziomie 10 ppm (29 mg/m3).TWA-PEL jest granicą narażenia, która nie może być przekroczona przez 8-godzinną TWAin każdą 8-godzinną zmianę w 40-godzinnym tygodniu pracy.,
toksyczność trifluorku azotu związana jest z jego zdolnością do fonn methemoglobiny, zmodyfikowanej fonn hemoglobiny niezdolnej do tlenu, oraz do niszczenia czerwonych krwinek (hemolizy). Po ustaniu ekspozycji methemoglobina spontanicznie powraca do hemoglobiny. Jednak przy wysokim poziomie ekspozycji może być konieczna interwencja terapeutyczna (tlen,błękit metylenowy, transfuzja wymienna). Występowanie hemolizy wymaga starannego monitorowania stopnia niedokrwistości i potencjałuzwraconej funkcji nerek.,
wartość TLV-TWA trifluorku azotu wynosząca 10 ppm wynikała z badania, w którym szczury narażone były na działanie 100 ppm przez 7 godzin dziennie, 5 dni w tygodniu przez 18 miesięcy. Nie wykryto żadnych zmian w zachowaniach zwierząt, częstości akcji serca lub płuc, krwiopijności lub pojawieniu się fluorozy. ACGIH ustawił TLV-TWA na poziomie III 0.
gazowy trifluorek azotu jest uważany za nieszkodliwy dla skóry i niewielki środek drażniący dla skóry i błon śluzowych.
magazynowanie
butle z trifluorkiem azotu muszą być bezpiecznie podparte podczas użytkowania, aby zapobiec przesuwaniu i obciążaniu połączeń., Pełne butle muszą być przechowywane w dobrze wentylowanym miejscu, chronione przed nadmiernym ciepłem( 125 ° F lub 51,7°C), umieszczone z dala od materiałów organicznych lub łatwopalnych i zabezpieczone. Pokrywy zabezpieczające zawór i pokrywy wylotowe zaworu muszą być bezpiecznie na miejscu przez cały czas, gdy cylinder nie jest używany.
Wysyłka
UN2451 trifluorek azotu, Klasa Zagrożenia: 2.2; etykiety: 2.2-niepalny Gaz sprężony; 5.1-utleniacz.Butle muszą być transportowane w bezpiecznej pozycji pionowej, w dobrze wentylowanej ciężarówce. Chronić cylinder i etykiety przed uszkodzeniami fizycznymi., Właściciel butli ze sprężonym gazem jest jedynym podmiotem dopuszczonym przez prawo federalne (49CFR) do ich transportu i napełniania. Jest to naruszenie transporturegulacje ponownego napełniania butli sprężonego gazu bez wyraźnej pisemnej zgody właściciela.
ocena toksyczności
toksyczność trifluorku azotu jest związana z jego zdolnością do fonn methemoglobiny, zmodyfikowanej fonn hemoglobiny niezdolnej do transportu tlenu i do niszczenia czerwonych krwinek (hemolizy). Po ustaniu ekspozycji methemoglobina spontanicznie powraca do hemoglobiny., Jednak przy wysokim poziomie ekspozycji może być konieczna interwencja terapeutyczna (tlen, błękit metylenowy, transfuzja wymienna). Występowanie hemolizy wymaga starannego monitorowania stopnia niedokrwistości i możliwości upośledzenia czynności nerek.
gaz jest silnym utleniaczem. Przedstawia groźne zagrożenie pożarowe w obecności środków redukujących. Wytrawia szkło w obecności wilgoci., Reaguje zoil, smar, środki redukujące i inne materiały utleniające; materiały palne, organiczne, amoniak, tlenek węgla; metan, Wodór, siarkowodór; węgiel aktywowany; diboran, woda. Może reagować gwałtownie z wodorem, amoniakiem, tlenkiem węgla, diboranem, siarkowodorem, metanem, tetrafluorohydrazyną,węglem drzewnym. Trifluorek azotu zwiększy intensywność istniejącego pożaru.
Utylizacja odpadów
, Odpowietrzyć do dużej objętości koncentratedreducing agent (wodorosiarczynów, soli żelaznych lub hypo)roztworu, a następnie zneutralizować i spłukać do kanalizacji z wielkimipowierzchniami wody.
dostępne gatunki
trifluorek azotu jest dostępny w klasach od 98 procent do 99,995 procent czystości V / vminimum.
