6.3 cum este energia legată de lungimea de undă a radiației?
ne putem gândi la radiații fie ca valuri, fie ca particule individuale numite fotoni. Energia asociată cu un singur foton este dată de E = hv , unde E este energia (unități SI J), h este constanta lui Planck (h = 6.626 x 10-34 J s), iar ν este frecvența radiației (unități SI de s–1 sau Hertz, Hz) (a se vedea figura de mai jos)., Frecvența este legată de lungimea de undă prin λ=c/ν , unde c, viteza luminii, este 2.998 x 108 m s–1. O altă cantitate pe care o veți vedea adesea este wavenumber, σ=1/λ, Care este frecvent raportată în unități de cm–1.energia unui singur foton care are lungimea de undă λ este dată de:
e = HC λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., Energia unui mol de fotoni care au lungimea de undă λ se găsește prin înmulțirea ecuației de mai sus cu numărul lui Avogadro:
E m = HC N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
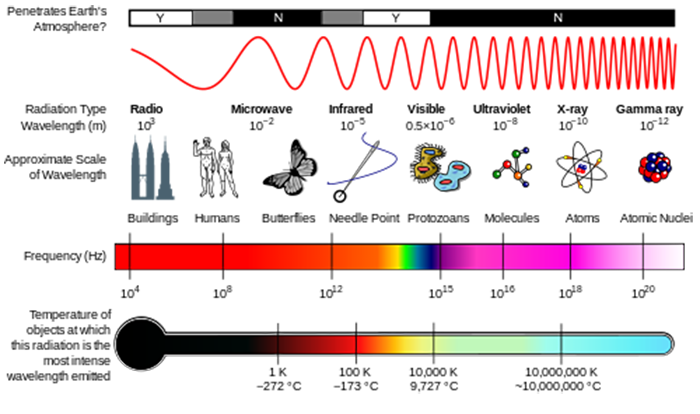
în lecția despre compoziția atmosferică, ați văzut cum radiațiile solare UV au fost capabile să descompună moleculele pentru a iniția chimia atmosferică. Aceste molecule absorb energia unui foton de radiație și dacă acea energie fotonică este mai mare decât puterea legăturii chimice, molecula se poate rupe.
verificați înțelegerea
luați în considerare reacția O3 + UV → O2 + o*. Dacă rezistența legăturii dintre O2 și O* (adică.,, atom de oxigen de stat excitat) este 386 kJ mol–1, Care este cea mai lungă lungime de undă pe care un foton poate avea și încă rupe această legătură?
răspuns: rezolva pentru lungimea de undă în ecuația
λ = 1.196 × 10 8 J nm mol -1 E M = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
