notația D și L pentru configurația absolută a zaharurilor și aminoacizilor
ce diferențiază „D-glucoza” de „L-glucoza” ? Sau D-alanină din L-alanină?
și ce este această nomenclatură D și l, oricum? Citiți mai departe:
cuprins
- D – și L – oferă o scurtă scurtă pentru desemnarea enantiomerilor
- De ce ne deranjăm cu această nomenclatură antică?,
- L – Și D – Sistem Pentru Atribuirea „Configurație Absolută”
- Patru-Carbon Aldehidă D – și L – Zaharuri (Aldotetroses)
- Cinci-Carbon Aldehidă D – și L – Zaharuri (Aldopentoses)
- Șase-Carbon Aldehidă D – și L – Zaharuri (Aldohexoses)
- Dar Stai – Acolo e Mai mult! (Aminoacizi)
- rezumat: D-și l-notația pentru zaharuri și aminoacizi
- Note
- referințe(avansate) și lecturi suplimentare
D – și L – oferă o prescurtare rapidă pentru desemnarea enantiomerilor
d – și l – notația oferă o prescurtare rapidă pentru desemnarea enantiomerilor.,
d-glucoza este enantiomerul l-glucozei, de exemplu. Deoarece L-alanina este enantiomerul D-alaninei.
acesta este atribuit după cum urmează. Pentru un zahăr tras în proiecția Fischer cu carbonul cel mai oxidat în partea de sus (adică aldehidă sau cetonă)
- dacă OH din Centrul chiral de jos indică spre dreapta, este denumit D-
- dacă OH din Centrul chiral de jos indică spre stânga, este denumit L- .
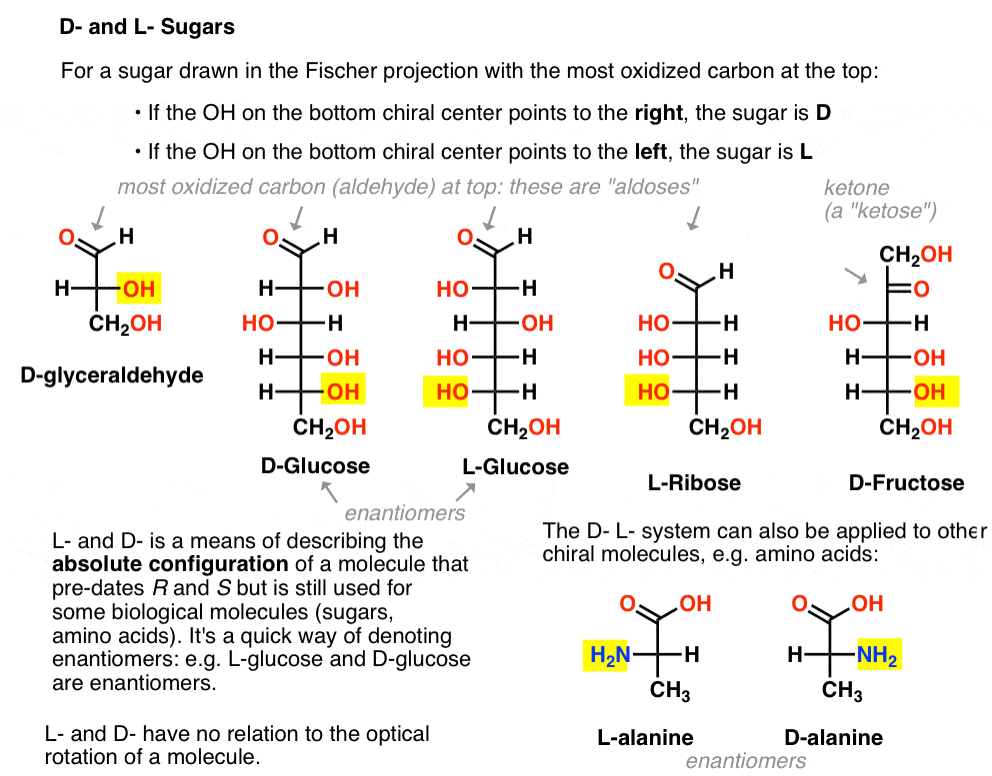
această terminologie poate fi aplicată și aminoacizilor: vezi L – și D – alanină în imaginea de mai sus.,
2. De Ce Ne Deranjăm Cu Această Nomenclatură Antică?
ați putea întreba în mod justificat: nu avem deja un sistem pentru atribuirea configurației absolute ? De ce avem nevoie de un nou sistem?
sistemul D-L nu este un sistem nou, oameni buni. Este vechiul sistem-înainte de Cahn-Ingold-Prelog.
D-L de sistem este literalmente o rămășiță de căruțe cu cai epocă, datând de la Emil Fischer munca pe carbohidrati la sfârșitul anilor 1800 – un moment când organic a avut nici o modalitate de a determina configurația absolută a stereocenters, care a devenit posibilă numai în 1951 (thx, Bijvoet).,
deci, de ce se mai obișnuiește? Nu ar trebui să fie expediat la coșul de gunoi al istoriei, împreună cu regulile de diapozitive, casetele cu 8 piste și dischetele de 5¼”?ei bine, există comunități înfloritoare în anumite părți ale Americii rurale, unde persistă trăsurile trase de cai-dacă știți unde să căutați. (Poate într-o zi vor exista comune în care oamenii folosesc doar tehnologia informatică din anii 1970 și 1980?)
De asemenea, există un buzunar de chimie organică în cazul în care sistemul D-L încă găsește utilizare, și că este în mod specific în domeniul de zaharuri și aminoacizi.,aceasta nu este o revoltă a chimiștilor Amish împotriva relelor moderne ale sistemului CIP, apropo. Există cel puțin 3 motive întemeiate, în cazul specific al zaharurilor și aminoacizilor, pentru utilizarea L – și D- :
- concizie. D-glucoza este o dracu ‘ de mult mai rapid pentru a scrie și spune decât (2R,3s,4R,5R)2,3,4,5,6-pentahidroxihexanal. Sistemul L – / D permite configurarea unei molecule cu mai multe centre chirale să fie rezumată cu o singură literă (plus numele său comun, desigur – datorită Noel pentru memento)
- mai multă concizie., Se întâmplă să fie o modalitate rapidă de a se referi la enantiomeri. Enantiomerul l-glucozei este D-glucoza. Enantiomerul L-triptofanului este D-triptofanul. Și în timp ce am putea folosi prefixele (+)- sau (–)- pentru a diferenția cei doi enantiomeri ai glucozei și ai altor zaharuri, semnul rotației optice poate varia în funcție de solvent, temperatură, concentrație și alți factori care îl fac mai puțin decât ideal. În plus, L – și D – se referă în mod specific la configurația absolută, în timp ce (așa cum am menționat anterior) nu există o relație simplă între semnul rotației optice și configurație.,
- se dovedește că zaharurile cele mai naturale sunt D-, iar aminoacizii cei mai naturali sunt L- . Există o cantitate imensă de informații comprimate în această afirmație și nu există un sistem concurent (R/S,+/–) care ar putea înlocui L – și D – cu un singur caracter. Notă
se repetă: cu zaharuri și aminoacizi, L – și D – pot fi denumiri utile. Pentru alte molecule, puteți uita în mare măsură despre asta. deci, ce este acest D-/L – sistem, și cum acești termeni se referă la structura?,
Alăturați – vă mie în timp ce călătorim înapoi prin timp…
sistemul L și D pentru atribuirea „configurației Absolute”
Emil Fischer a început să studieze carbohidrații la sfârșitul anilor 1880. se știa până atunci (prin Van ‘ t Hoff) că carbonul era tetraedric, și se știa, de asemenea, că moleculele care conțin un carbon cu patru substituenți diferiți puteau roti lumina polarizată în plan (de exemplu, Pasteur). Ceea ce nu se știa era configurația absolută a niciuneia dintre moleculele chirale – ceea ce am numi astăzi configurațiile lor „R” și „S”.,cel mai simplu carbohidrat care conține un centru chiral este gliceraldehida, C3H6O3. Gliceraldehida are trei atomi de carbon; făcându-l o „trioză”. Carbonul cel mai oxidat din gliceraldehidă este o aldehidă, care o face și o „aldoză”.
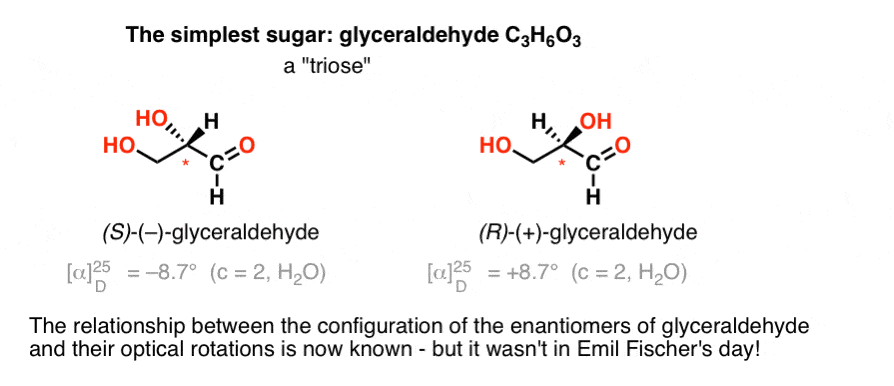
În 1888, cei doi enantiomeri de gliceraldehid au fost izolate și caracterizate., Dar, deoarece nu există o simplă corelație între configurația unui centru chiral și direcția în care acesta rotește lumina polarizată în plan, Emil Fischer nu a avut cum să lege rotația optică a ( + )-și ( – ) –gliceraldehidei de configurația absolută a atomilor din jurul centrului chiral.folosind terminologia de astăzi, el nu avea cum să știe dacă ( – ) – gliceraldehida era (R) sau (S).în lipsa acestei informații cheie, Fischer a ales să ghicească.,
ghici, care s-a dovedit a fi corect, a fost că (–)-gliceraldehid avut configurare numim acum S, și că (+)-gliceraldehid are configurația noi numim acum R.
desigur, Cahn, Ingold și Prelog nu a fost încă născut, și CIP sistem s-ar fi dezvoltat după Bijvoet de muncă în 1951. Deci Fischer și-a dezvoltat propria nomenclatură.
Desen gliceraldehid în ceea ce mai târziu va fi numit Fischer de proiecție, el a atribuit configurația de pe stânga (–)-gliceraldehid, și a numit-o L- (prescurtarea de la latină laevo )., El a atribuit apoi configurația din dreapta la (+)- gliceraldehidă și a numit – O D – (pentru dextro Latin ).
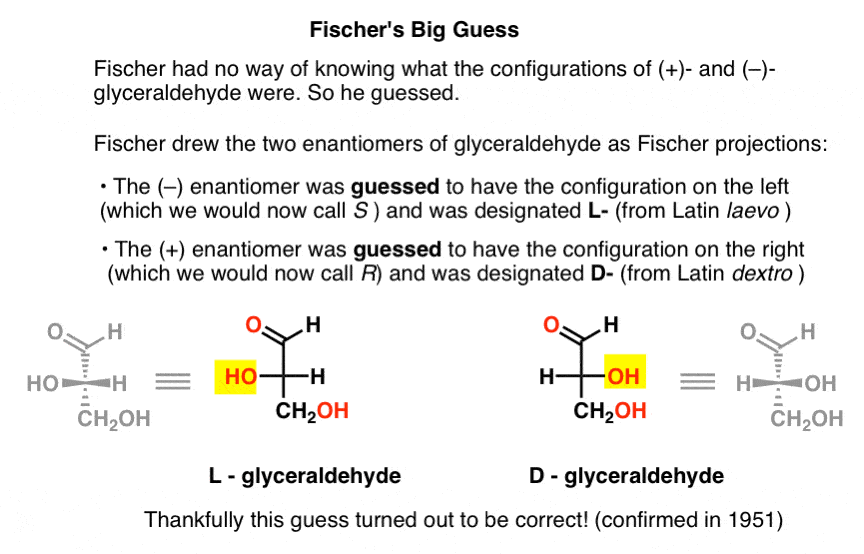
de ce este acest lucru atât de important?
atribuirea configurației absolute pentru l – și D – gliceraldehida a fost un pic ca atribuirea meridianului prim (0° longitudine) Observatorului Regal din Greenwich, Anglia., Doar ca longitudinea de orice alt loc de pe pământ ar putea fi determinată în raport cu acel punct în cazul lor distanțele relative au fost cunoscute, configurația absolută de fiecare alte stereocenter ar putea fi apoi determinată dacă configurația sa rudă să-L sau D – gliceraldehid-a fost cunoscut.
aceasta ar putea să nu fie cea mai clară analogie. Deci, să ne uităm la zaharurile cu 4 carbon pentru un alt exemplu.,odată ce au fost propuse configurațiile absolute ale L – și D – gliceraldehidei, configurațiile absolute ale altor compuși chirali ar putea fi apoi stabilite prin analogie (și o mulțime de lucrări chimice).
nu este crucial pentru ziua de azi, dar pentru un exemplu de acest tip de raționament, a se vedea acest lucru . când a fost introdus conceptul de centre chirale, probabil ați aflat că o moleculă cu centre chirale n va avea stereoizomeri 2N (atâta timp cât nu există compuși mezo).,există două aldoze cu patru carbon, treoză și eritroză. Fiecare are două centre chirale. Fiecare există ca o pereche de enantiomeri (L – și D- ) dând patru stereoizomeri în total.
Iată-le. Cel mai important lucru de remarcat în figura de mai jos este că familia l de zaharuri are grupul OH al carbonului chiral de jos în stânga, iar familia D are grupul OH al carbonului chiral de jos în dreapta (evidențiat).,
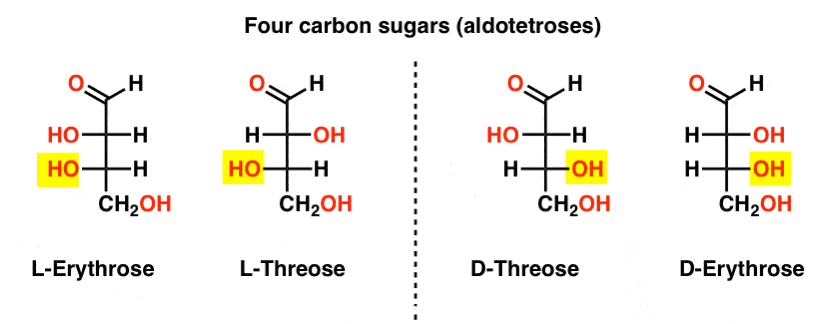
Vezi cum L-Erythrose și L-Threose construi pe stereocenter stabilit în L-gliceraldehid (subliniat), și D-Erythrose și D-Threose construi pe stereocenter stabilit în D-gliceraldehid (subliniat).zaharurile sunt construite puțin ca sistemul binar; vă puteți gândi că fiecare stereocentru este un ” bit ” care poate avea una din cele două valori. Configurația l-eritrozei și L-threose diferă doar la un stereocenter. Dacă ar fi să răsturnăm poziția lui H și OH, l-am lua pe celălalt., Această relație are un nume care s-ar putea vedea uneori: două molecule care au configurația opusă la doar o stereocenter sunt numite epimers, în special atunci când unul dintre atomii atașat la stereocenter este un hidrogen (H).cel mai cunoscut nume de pe această listă ar trebui să fie riboza, care este coloana vertebrală a zahărului acidului ribonucleic (ARN).în partea stângă în diagrama de mai jos, avem l-aldopentozele, care au aceeași configurație a stereocentrului inferior atunci când aldehida este plasată în partea superioară.,enantiomerii lor, D-aldopentozele, sunt pe partea dreaptă, care au aceeași configurație a stereocentrului inferior (evidențiat).
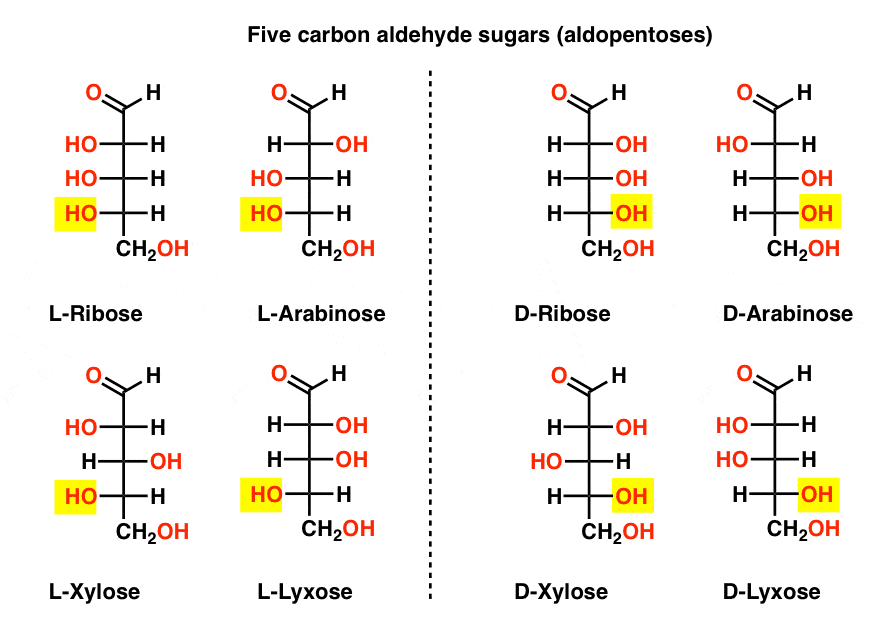
în acest moment ar trebui să subliniem că majoritatea covârșitoare a zaharurilor din formele de viață pe Pământ sunt d-zaharuri, inclusiv D – riboza ca coloană vertebrală a ARN. De ce și cum toate organismele de pe pământ au ajuns cu D-zaharuri este un mister, așa cum se presupune că l-zaharuri ar fi lucrat la fel de bine.,
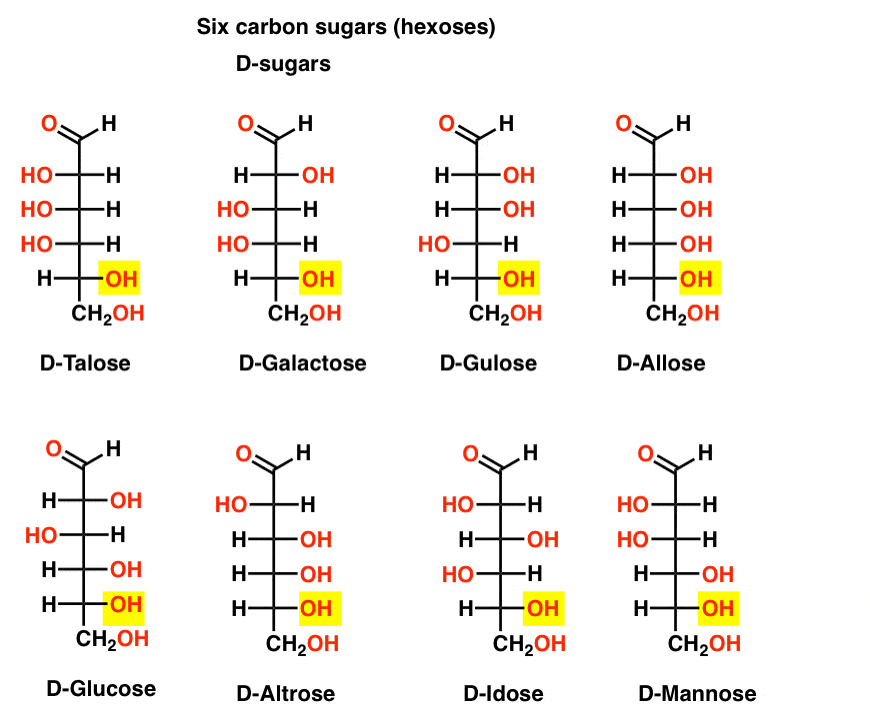
Șase atomi de Carbon Aldehidă D – și L – Zaharuri (Aldohexoses)
Dacă există 4 aldopentoses, unul ca D – L – pereche de enantiomeri (8 stereoizomeri total) atunci cum de multe aldohexoses sunt acolo?există 8 perechi D – L (16 stereoizomeri în total). Cea mai cunoscută este glucoza, dar probabil veți recunoaște manoza și galactoza. Unele sunt rareori, dacă vreodată, găsite în natură (idose, oricine?).iată d-aldohexozele. Observați cum toate au aceeași configurație a Centrului chiral inferior – aceeași pe care am văzut-o în D-gliceraldehida.,
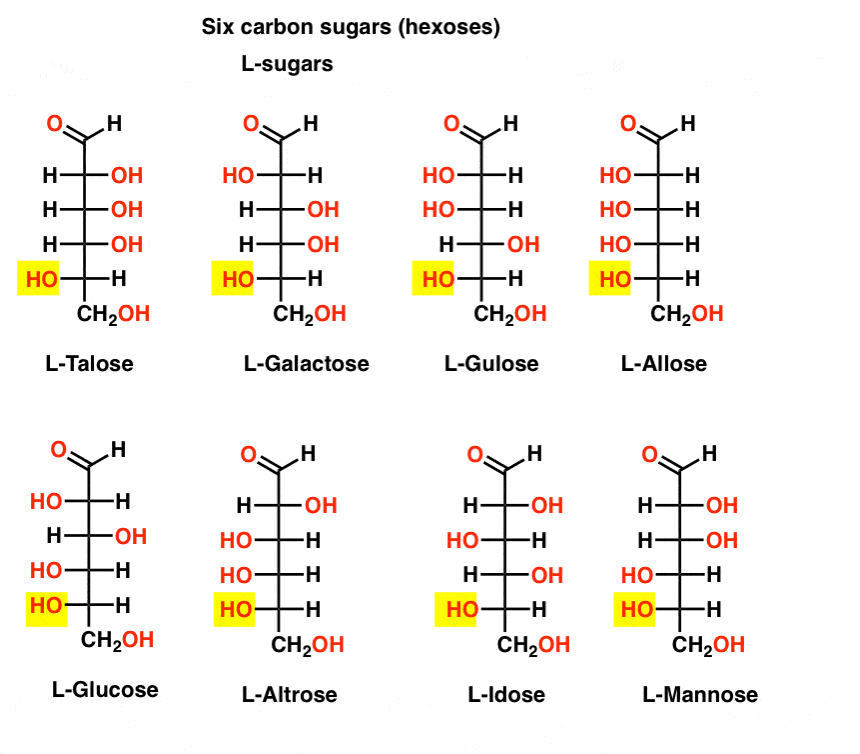
spre deosebire de zaharurile D, zaharurile L (de mai jos) sunt rareori găsite în natură. Interesant este că L-glucoza a fost explorată ca înlocuitor de zahăr. Gustul său este imposibil de distins de D-glucoza naturală, dar nu oferă hrană, deoarece nu poate fi descompusă de enzimele noastre (chirale). După cum se dovedește, producția este prea scumpă pentru a concura cu splenda, stevia, aspartam et. al.
OK, asta e de ajuns. Șapte-carbon zaharuri au fost făcute (aldoheptoses), dar ele nu sunt semnificative biologic.,
7. Dar așteptați – este mai mult! (Aminoacizi)
dacă desenați aminoacizi în proiecția Fischer cu grupul cel mai oxidat din partea de sus (acidul carboxilic), atunci puteți atribui și L – și D-.din cei 19 aminoacizi chirali care sunt încorporați în proteine (proteinogenic este termenul potrivit) sunt toți L- . (Glicina este achirală, deci D-și L-nu se aplică). Unii D-aminoacizi apar în mod natural, dar sunt rare (mai ales găsite în bacterii, cu excepția notabilă a veninului platypus) și nu sunt codificate de ARNm.,interesant este că, deși toți cei 19 aminoacizi chirali sunt L -, doar 18 din cei 19 Sunt (S). Care este excepția?
(Acest lucru este bun chimie organică bar trivia).
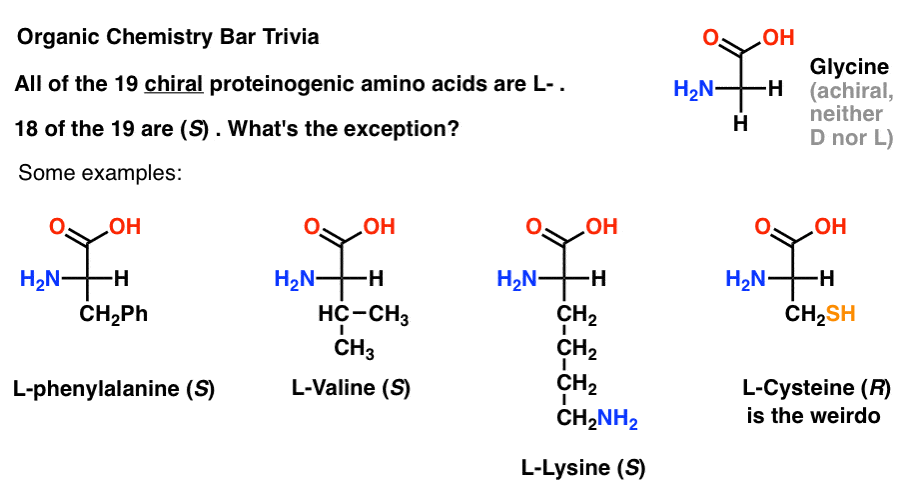
cisteina este ciudatul.
(puncte Bonus dacă ați spus și selenocisteină … tocilar).
rezumat: D-și l-notație pentru zaharuri și aminoacizi
deci, care este D-L-Sistem pentru atribuirea de configurație absolută. Funcționează bine pentru zaharuri, deoarece acestea pot fi construite atât de sistematic (cum ar fi sistemul binar). Este, de asemenea, util pentru aminoacizi., Punctul cheie este doar să privim stereocentrul de jos în timp ce este desenat în proiecția Fischer. Corect? D. Stânga? Desigur, zaharurile nu sunt întotdeauna desenate atât de util în proiecțiile Fischer – ele formează inele. Vom scrie despre determinarea D – și L-în zaharuri ciclice într-un post viitor.tot ce trebuie să spun este să mulțumesc oricărei zeități pe care o alegeți să o credeți că presupunerea lui Fischer s-a dovedit a fi corectă. Ar fi o durere enormă în fund pentru a trece prin anii 70+ din literatura chimică știind că configurația greșită a fost atribuită tuturor zaharurilor și aminoacizilor.,vă mulțumim pentru Thomas Struble pentru asistență cu acest post.
Note
Nota 1. „penultima stereocenter în cele mai multe chirali zaharuri este R, în timp ce stereocenter în cele mai multe aminoacizi este S” nu sună la fel, mai ales că cisteina este R. ]
Notă. Iată un experiment de gândire pentru determinarea configurațiilor relative ale eritrozei și treozei., (Spun „experiment de gândire” pentru că nu vreau să includ reactivi specifici, care ar putea distrage atenția)
Dacă se începe cu pur (+)-erythrose și se oxidează la alcool primar la o aldehidă folosind metode cunoscute, se obține un compus lipsit de orice rotația optică. Același lucru este valabil și pentru (–)-eritroză, care returnează un compus complet identic. Din aceasta se poate deduce că structura noului compus trebuie să fie astfel încât molecula să aibă un plan oglindă intern (adică este meso). .,
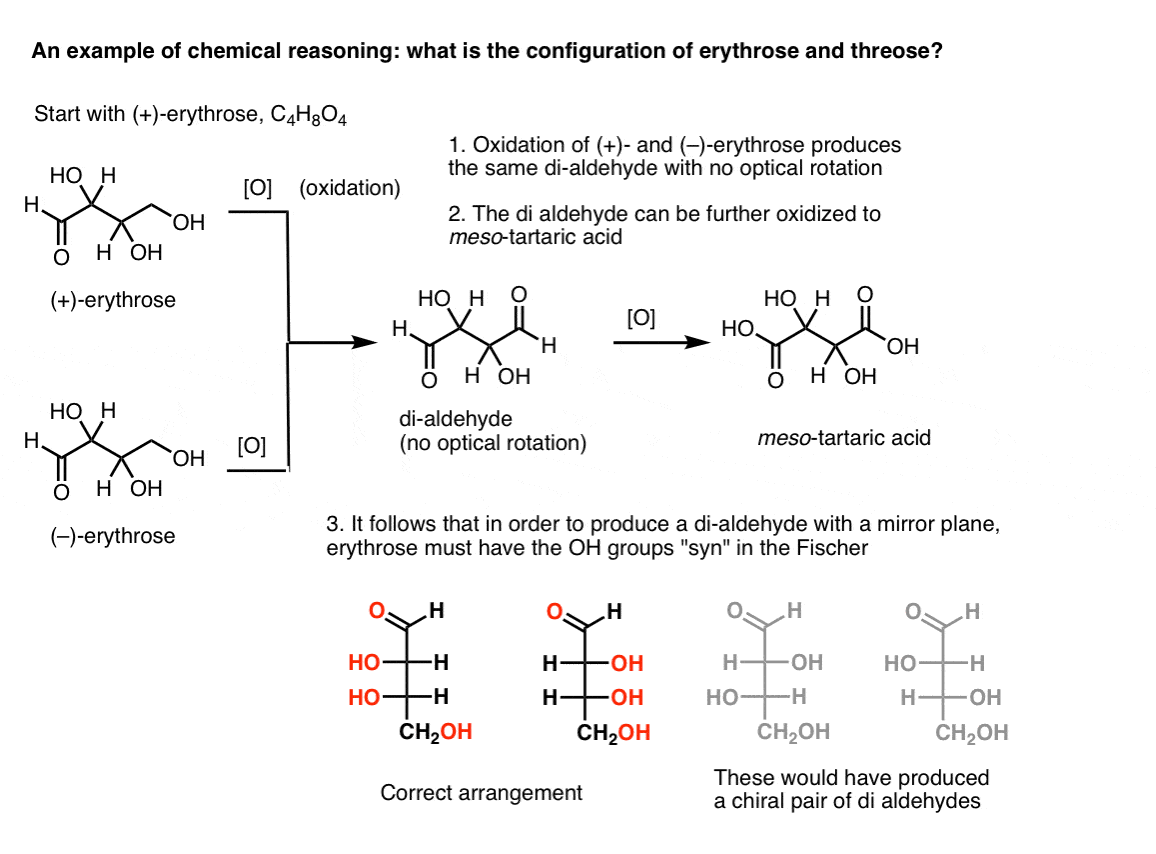
În contrast, care efectuează aceeași operație pe (+)-threose rezultatele într-o di-aldehidă, care menține rotația optică. Un compus cu rotație optică egală și opusă este format prin efectuarea aceleiași operații pe (–)-threose. Acești doi compuși sunt enantiomeri. Pentru ca acest lucru să fie adevărat, orientarea relativă a grupărilor hidroxil în treoză trebuie să fie anti. Acești compuși pot fi oxidați în continuare pentru a produce, respectiv, acid (–)- și (+)- tartric.,
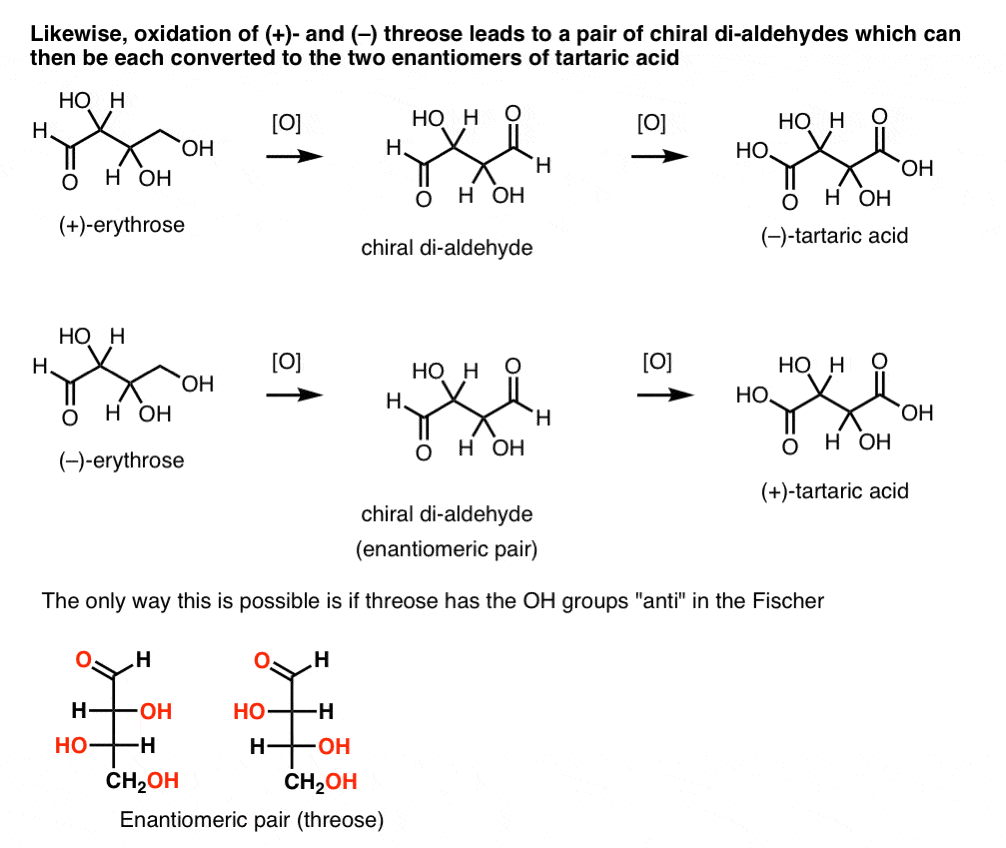
același raționament poate fi utilizat în direcția opusă (reducere). De exemplu, fie (+)- sau (–)- eritroza poate fi redusă la Tetra-ol eritritol, care este meso.de asemenea, reducerea treozei ( + ) și ( – ) are ca rezultat o pereche enantiomerică de tetra – ols, treitol.din aceste fapte putem deduce orientarea relativă a grupurilor OH.
(Avansat) Referințe și lecturi Suplimentare
- Über die Bezeichnung von optischen Antipoden durch die Buchstaben d und l
Emil Fischer
Ber. 1907, 40 (1), 102-106
doi: 10.,1002 / cber.19070400111
aceasta este faimoasa lucrare în care Prof. Emil Fischer (arbitrar!) atribuit (- )-gliceraldehidă l-stereochimie. - sinteze în grupul Purin și zahăr
Emil Fischer
prelegerea Nobel, 1902prelegerea Nobel a lui Fischer, unde vorbește despre munca sa nu doar în carbohidrați, ci și în purine, din care fac parte compuși precum cofeina și teobromina. Prof. Fisher prezice creșterea băuturilor energizante (de ex., Red Bull), afirmând: „cu puțină imaginație poate fi prevăzută ziua în care fasolea nu va mai fi necesară pentru a face o cafea bună: o cantitate mică de pulbere dintr-o substanță chimică care funcționează împreună cu apa va oferi o băutură savuroasă și răcoritoare surprinzător de ieftin”.
- Determinarea Configurației Absolute de Compuși Optic Activi prin Intermediul Razelor X
BIJVOET, J., PEERDEMAN, A. & van BOMMEL, A.,
Natura 1951, 168, 271-272
DOI: 1038/168271a0
celebra lucrare care s-a dovedit, cu ajutorul X-ray structurală de analiză, că „Emil Fischer convenție, care a atribuit configurația din Fig. 2 la acidul dextrorotator, pare să răspundă realității”. - descoperirea lui Emil Fischer a configurației glucozei. Un semicentennial retrospectivă
C. S. Hudson
Jurnal al Învățământului Chimic 1941, 18 (8), 353
DOI: 10.1021/ed018p353
O revizuire timpurie, care acoperă Prof. Emil Fischer de muncă în carbohidrați chimie., - dovada lui Emil Fischer a configurației zaharurilor:un tribut centenar
Frieder W. Lichtenthaler
Angew. Chem. Int. Ed. 1992, 31 (12), 1541-1556
DOI: 10.1002/anie.199215413
O revizuire foarte lizibilă din 1992 care acoperă activitatea Prof.Fischer în chimia carbohidraților și merge în profunzime în misiunile stereochimice ale carbohidraților.
