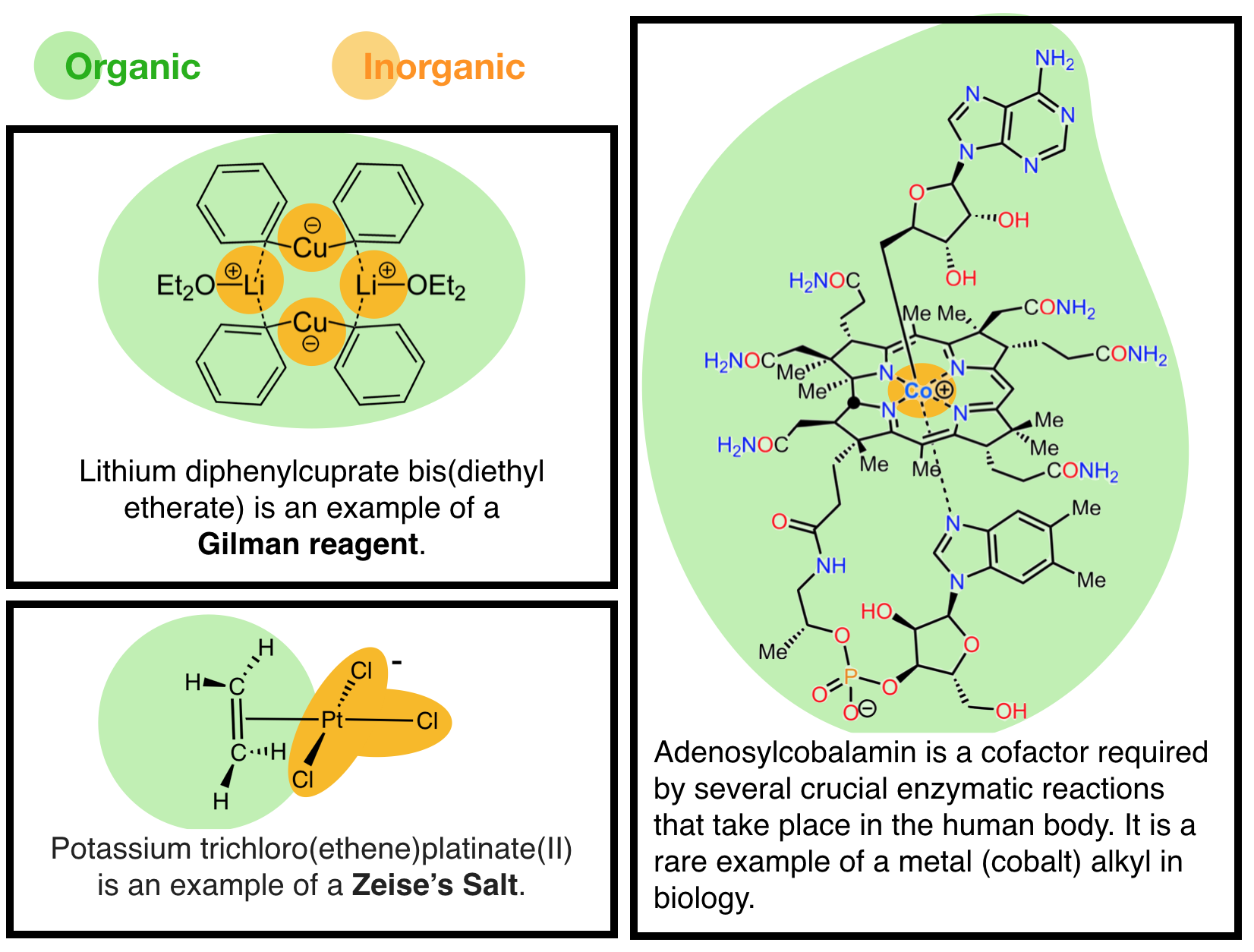
Die Trennung zwischen den Bereichen Anorganische und Organische Chemie ist verschwommen. Betrachten wir zum Beispiel eine der Hauptklassen von Katalysatoren, die für organische Synthesereaktionen verwendet werden; organometrische Katalysatoren (Abbildung \(\pageIndex{1}\)). Organometallische Katalysatoren wie diese und alle organometallischen Verbindungen enthalten Metalle, die an Kohlenstoff oder kohlenstoffhaltige Moleküle gebunden sind. Sind sie also „anorganisch“, weil sie Metalle enthalten, oder“ organisch“, weil sie Kohlenstoff enthalten?, Diese zeigen, dass es keine klaren Trennlinien zwischen organischer und anorganischer Chemie gibt. Ferner sind Metallionen in der Biologie üblich und daher ist die Vorstellung, dass Metalle „anorganisch“ sind und daher als „nicht lebend oder nicht biologisch“ eingestuft werden, falsch. Ein kanonisches Beispiel ist der organometallische Katalysator Adenosylcobalbumin, ein wichtiger biologischer Cofaktor, der ein Kobalt (Co)-Ion enthält (Abbildung \(\pageIndex{1}\), rechts) und eine Kobalt-Kohlenstoff-Bindung.
Einige der Teilbereiche der anorganischen Chemie konzentrieren sich auf die elektrische Leitfähigkeit anorganischer Materialien (dh Leitung, Supraleitung und Halbleiter) und auf die Untersuchung optischer und elektronischer Eigenschaften anorganischer Nanomaterialien., Elektrische Leitfähigkeit ist eine kanonische Eigenschaft von Metallen, aber auch Materialien auf Kohlenstoffbasis zeigen elektrische Leitfähigkeit. Zum Beispiel leiten Kohlenstoffnanoröhren Elektrizität durch ihre erweiterten konjugierten \(\pi\) Systeme. Fullerene, von denen das bekannteste Buckminsterfullerene oder Buckeyball (C60) ist, zeigen interessante Eigenschaften, die Nanopartikeln ähnlich sind, und wenn sie mit Metallen kombiniert und kristallisiert werden, können sie Supraleitung zeigen.,
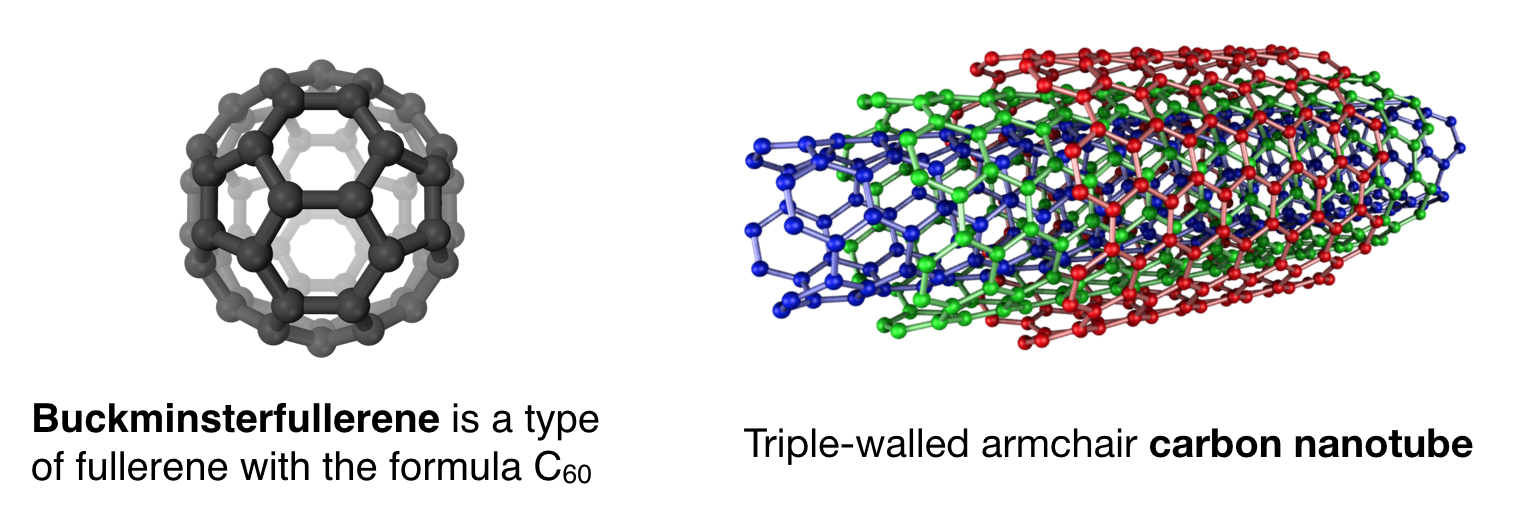
Obwohl Kohlenstoffnanoröhren und Fullerene Allotrope von Kohlenstoff sind, sind ihre Materialeigenschaften vielen organischen Chemikern, die sich traditionell auf kleinere organische Moleküle mit sehr unterschiedlichen Eigenschaften konzentriert haben, etwas fremd., Diese Eigenschaften sind jedoch anorganischen Chemikern bekannt. So haben anorganische Chemiker diese Moleküle als „anorganisch“ angenommen, da sie sich eher wie anorganische Materialien verhalten als kleinere organische Moleküle. Diese Klasse kohlenstoffbasierter Moleküle dient als weiteres Beispiel für Moleküle, die nicht perfekt auf die traditionellen Definitionen der „organischen“ und „anorganischen“ Chemie abgestimmt sind. Sicherlich wird die Zukunft immer mehr Beispiele für Moleküle enthalten, die nicht in die traditionellen Disziplinen der Chemie passen.
