Andere Serien
\
Die Werte für \(n_2\) und Wellenzahl \(\widetilde{\nu}\) für diese Serie wäre:
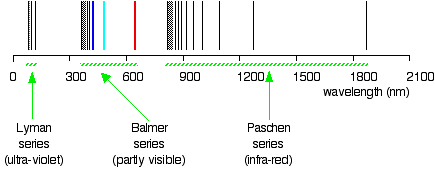
wissen Sie, in welcher region der elektromagnetische Strahlung, diese Zeilen sind? Natürlich befinden sich diese Linien im UV-Bereich und sind nicht sichtbar, aber sie werden von Instrumenten erkannt; Diese Linien bilden eine Lyman-Reihe., Die Existenzen der Lyman-Serie und Balmers Serie deuten auf die Existenz weiterer Serien hin. Für Beispiel, die Reihe mit \(n_2 = 3\) und \(n_1\) = 4, 5, 6, 7, … heißt Pashen Serie.
Mulitple series
Beispiel \(\paeindex{1}\): Die Lyman-Reihe
Die sogenannte Lyman-Linienreihe im Emissionsspektrum von Wasserstoff entspricht Übergängen von verschiedenen angeregten Zuständen in die n = 1-Umlaufbahn. Berechnen Sie die Wellenlänge der niedrigsten Energielinie in der Lyman-Serie auf drei signifikante Zahlen. In welchem Bereich des elektromagnetischen Spektrums tritt es auf?,
Gegeben: niedrigste Energiebahn in der Lyman-Reihe
Gefragt nach: Wellenlänge der Lyman-Linie mit der niedrigsten Energie und dem entsprechenden Bereich des Spektrums
Strategie:
Lösung:
Wir können die Rydberg-Gleichung (Gleichung \ref{1.5.1}) verwenden, um die Wellenlänge zu berechnen:
\
A Für die Lyman-Reihe, \(n_1 = 1\).
Spektroskopiker sprechen oft von Energie und Frequenz als Äquivalent. Die cm-1 Einheit (wavenumbers) ist besonders bequem. Wir können die Antwort in Teil A in cm-1 konvertieren.,
und
\
Diese Emissionslinie wird Lyman alpha genannt und ist die stärkste atomare Emissionslinie von der Sonne und treibt die Chemie der oberen Atmosphäre aller Planeten an, die Ionen produzieren, indem Elektronen aus Atomen und Molekülen entfernt werden. Es wird vollständig von Sauerstoff in der oberen Stratosphäre absorbiert und dissoziiert O2-Moleküle zu O-Atomen, die mit anderen O2-Molekülen reagieren, um stratosphärisches Ozon zu bilden
B Diese Wellenlänge befindet sich im ultravioletten Bereich des Spektrums.,
\ \ (\pageIndex{1}\): Die Pfund-Reihe
Die Pfund-Linienreihe im Emissionsspektrum von Wasserstoff entspricht Übergängen von höheren angeregten Zuständen zum \(n_1 = 5\). Berechnen Sie die Wellenlänge der zweiten Zeile in der Pfund-Reihe auf drei signifikante Zahlen. In welchem Bereich des Spektrums liegt es?
Answer
\(4.65 \times 10^3\, nm\); infrared
Die obige Diskussion stellt nur eine phänomenologische Beschreibung der Wasserstoffemissionslinien dar und liefert keine Beschreibung der Natur des Atoms selbst., Es ist klar, dass ein Kontinuummodell, das auf der klassischen Mechanik basiert, nicht anwendbar ist, und wie der nächste Abschnitt zeigt, kann eine einfache Verbindung zwischen Spektren und atomarer Struktur formuliert werden.
