6.3 Wie hängt Energie mit der Wellenlänge der Strahlung zusammen?
Strahlung können wir uns entweder als Wellen oder als einzelne Teilchen vorstellen, die Photonen genannt werden. Die Energie, die einem einzelnen Photon zugeordnet ist , ist gegeben durch E = hv, wobei E die Energie (SI–Einheiten von J), h die Plancksche Konstante (h = 6.626 x 10-34 J s) und ν die Frequenz der Strahlung (SI-Einheiten von s-1 oder Hertz, Hz) ist (siehe Abbildung unten)., Frequenz ist im Zusammenhang mit der Wellenlänge von λ=c/ν , wobei c die Lichtgeschwindigkeit ist 2.998 x 108 m s–1. Eine andere Größe, die Sie oft sehen werden, ist die Wellenzahl σ=1/λ, die üblicherweise in Einheiten von cm–1 angegeben wird.
Die Energie eines einzelnen Photons mit der Wellenlänge λ ist gegeben durch:
E = hc λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., Die Energie eines Mols von Photonen mit der Wellenlänge λ wird gefunden, indem die obige Gleichung mit der Avogadro-Zahl multipliziert wird:
E m = hc N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
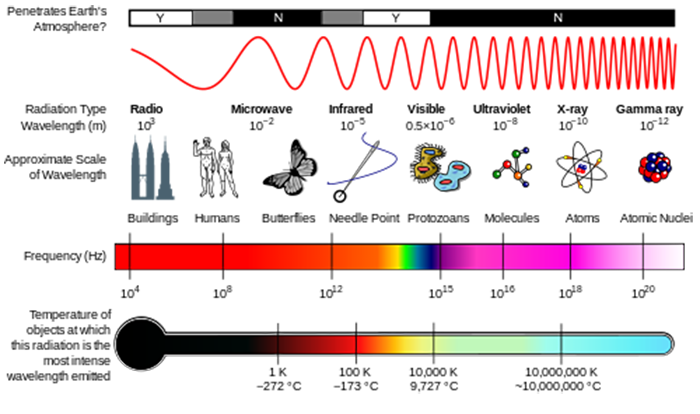
In der Lektion über atmosphärische Zusammensetzung, Sie sahen, wie solare UV-Strahlung in der Lage war, Moleküle auseinander zu brechen atmosphärische Chemie zu initiieren. Diese Moleküle absorbieren die Energie eines Strahlungsphotons, und wenn diese Photonenenergie größer als die Stärke der chemischen Bindung ist, kann das Molekül auseinanderbrechen.
Überprüfen Sie Ihr Verständnis
Betrachten Sie die Reaktion O3 + UV – → O2 + O*. Wenn die Bindungsstärke zwischen O2 und O* (d. h.,, angeregter Zustand Sauerstoffatom) ist 386 kJ mol-1, was ist die längste Wellenlänge, die ein Photon haben kann und immer noch diese Bindung brechen?
ANTWORT: Lösen Sie für die Wellenlänge in Gleichung
λ= 1.196 × 10 8 J nm mol -1 E (m) = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
