Einführung in die Carbonylgruppe
In der organischen Chemie ist die Carbonylgruppe eine funktionelle Gruppe, in der Kohlenstoff und Sauerstoffatom mit einer Doppelbindung verbunden sind. Die Verbindungen enthalten Carbonylgruppe sind als Carbonylverbindungen bekannt. Carbonylgruppe bezieht sich auf ein Kohlenmonoxid, das auch als Ligand an ein anorganisches Atom gebunden werden kann, das als Metallcarbonyl bezeichnet wird, z. B. Nickelkarbonyl.,
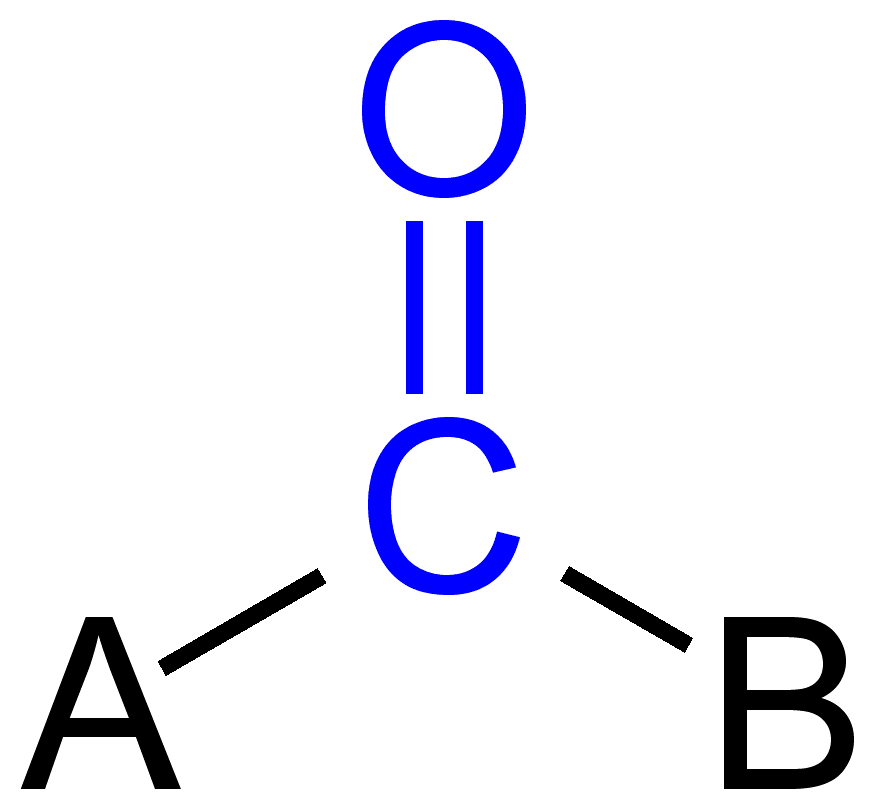
Einige Carbonylgruppen
Doppelbindung in Carbonylgruppe
Das Kohlenstoff-und Sauerstoffatom in Carbonylgruppe sind normalerweise sp2 hybridisiert und somit plannar. Aufgrund der Anwesenheit von Sauerstoff als elektronegatives Atom unterscheidet sich die Doppelbindung in der Carbonylgruppe hinsichtlich der Reaktivität von der Doppelbindung in Alkenen. Aufgrund der Elektronegativität und des Vorhandenseins von zwei einsamen Elektronenpaaren wird Sauerstoff teilweise negativ geladen, während Carbonylkohle teilweise positive Ladung erzeugt und somit Polarität beobachtet wird.,
Carbonylresonanzstruktur
Aufgrund der Anwesenheit von Sauerstoff als elektronegatives Atom zeigt Carbonylgruppe Resonanzstruktur. Resonanzstruktur der Carbonylgruppe beeinflussen die Reaktivität der Verbindung. Das elektronegativere Sauerstoffatom zieht Elektron vom Kohlenstoffzentrum weg und macht den Carbonylkohlenstoff teilweise elektropositiv und den Sauerstoff teilweise elektronegativ. Somit erzeugt Polarität innerhalb der Carbonylverbindung.
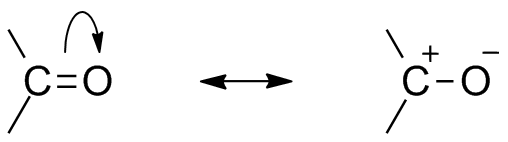
Dieser elektropositive Carbonylkohlenstoff bzw.,
Reaktivität
Carbonylalkylierung
Alkylierung der Carbonylgruppe durch nukleophile Additionsreaktion mit Grignard-Reagenz werden wie folgt gezeigt:

Physikalische Eigenschaften von Carbonylverbindungen
- Der Siedepunkt von Aldehyden und Ketonen ist höher als der Siedepunkt von Ethern und Alkanen ähnlicher molekularer Masse.
- Wiederum ist der Siedepunkt von Aldehyden und Ketonen niedriger als die entsprechenden Alkohole.,
- Viele höhere Aldehyde haben einen angenehmen Geruch und werden in Parfums oder als künstliches Aroma verwendet, während das untere Mitglied ihrer homologen Serie einen stechenden Geruch hat.
- Höhere Ketone haben milden Geruch und niedriger haben angenehmen Geruch, wie Aceton.
- Kleine Aldehyde und Ketone sind in Wasser löslich, aber mit zunehmender Kettenlänge nimmt die Löslichkeit ab.
- Die van der Waals Dispersionskräfte werden stärker, wenn die Moleküle länger werden.,
H-Bindung in Carbonyl-goup
Aufgrund der Bildung von H-Bindung zwischen dem Carbonyl-Sauerstoff und dem Wasserstoff des Wassermoleküls sind die unteren Carbonylverbindungen in Wasser löslich. Aber wenn die Kette zunimmt, kommt sie auf dem Weg zur Bildung einer Wasserstoffbindung und die Löslichkeit nimmt ab.
Van der Waals Dipol-Dipol-Anziehung
Aufgrund der Polarität in Carbonylgruppe und der Anwesenheit von Dispersionskräften wird es eine Anziehung zwischen zwei nahe gelegenen Molekülen geben. Dies bewirkt, dass der Siedepunkt von Carbonylverbindungen höher gehen, dass die entsprechenden Alkane., In der folgenden Tabelle wird darauf hingewiesen, dass der Siedepunkt von Carbonylverbindungen höher als die entsprechenden Alkane und niedriger als die Alkohole ist.,v>Boiling point (o C)
Spectroscopy
Infrared spectroscopy
The absorption of carbonyl group depends on the geometry of the molecule., Normalerweise zeigt die Absorption von Infra-Licht bei at-Wellenzahlen ungefähr 1600-1900 cm-1 (5263 nm bis 6250 nm).
Kernspinresonanz
Der Kohlenstoff-NMR von Carbonylkohlenstoff zeigt einen Peak zwischen 160-220 ppm.
