6.3 jak souvisí energie s vlnovou délkou záření?
záření můžeme považovat buď za vlny, nebo za jednotlivé částice zvané fotony. Energie spojené s jediného fotonu je dána vztahem E = hv , kde E je energie (v jednotkách J), h je Planckova konstanta (h = 6.626 x 10-34 J. s), ν je frekvence záření (SI jednotky s–1 nebo Hertz, Hz) (viz obrázek níže)., Frekvence souvisí s vlnovou délkou λ=c / ν, kde c, rychlost světla, je 2,998 x 108 m s-1. Další množství, které často uvidíte, je wavenumber, σ=1 / λ, který se běžně uvádí v jednotkách cm–1.
energie jediného fotonu, který má vlnovou délku λ, je dána:
E = hc λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., Energie mol fotonů, které mají vlnovou délku λ, se zjistí vynásobením výše uvedené rovnice číslem Avogadro:
E m = hc N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
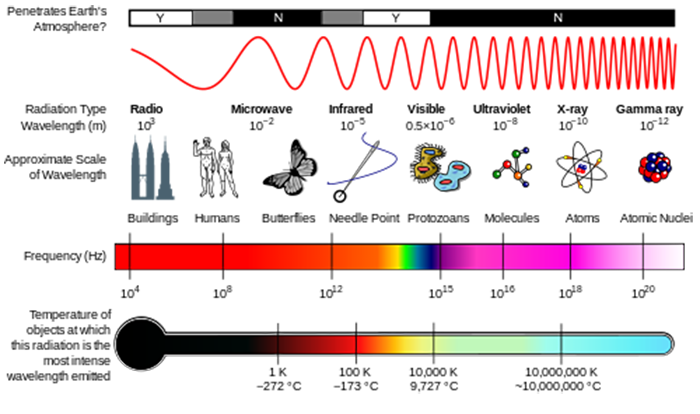
V lekci o složení atmosféry, viděl jsi, jak se sluneční UV záření byl schopen rozdělit molekuly zahájit atmosférické chemie. Tyto molekuly absorbují energii fotonu záření, a pokud je tato fotonová energie větší než síla chemické vazby, molekula se může rozpadnout.
Zkontrolujte své porozumění
zvažte reakci O3 + UV → O2 + o*. Pokud je síla vazby mezi O2 a o* (tj.,, excitovaného stavu atomu kyslíku) je 386 kJ mol–1, jaká je nejdelší vlnovou délku, že foton může mít a stále zlomit toto pouto?
odpověď: řešení pro vlnovou délku v rovnici
λ = 1.196 × 10 8 J nm mol -1 E m = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
