D – A L – Notace Pro Absolutní Konfigurace Cukrů A Aminokyselin
to, Co odlišuje „D-Glukózy“ od „L-Glukóza“ ? Nebo D-alanin z L-alaninu?
a co je to vlastně D-a L-nomenklatura? Číst dál:
Obsah
- D – a L – Poskytuje Rychlý Zkratka Pro stanovení Enantiomerů
- Proč se Obtěžovat S Tímto Starověké Nomenklatury?,
- L – A D – Systém Pro Přiřazení „Absolutní Konfiguraci“
- Čtyři-Uhlík Aldehydu D – a L – Cukry (Aldotetroses)
- Five-Uhlík Aldehydu D – a L – Cukry (Aldopentoses)
- Šest-Uhlík Aldehydu D – a L – Cukry (Aldohexoses)
- Ale Počkejte – je Tam Víc! (Aminokyselin)
- Shrnutí: D – a L – Notace Pro Cukry a Aminokyseliny
- Poznámky
- (Pokročilé) Odkazy a Další Čtení
D – A L – Poskytuje Rychlý Zkratka Pro stanovení Enantiomerů
D – a L – notace poskytuje rychlý zkratka pro stanovení enantiomerů.,
D-glukóza je například enantiomer l-glukózy. Jako L-alanin je enantiomer D-alaninu.
je přiřazen následujícím způsobem. Pro cukr vypracován v Fischerova projekce se nejvíce oxiduje uhlík v horní části (tj. aldehyd nebo keton)
- li – na spodní chirální centrum bodů na pravé straně, to je odkazoval se na jako D-
- li – na spodní chirální centrum bodů na levé straně, to je odkazoval se na jako L- .
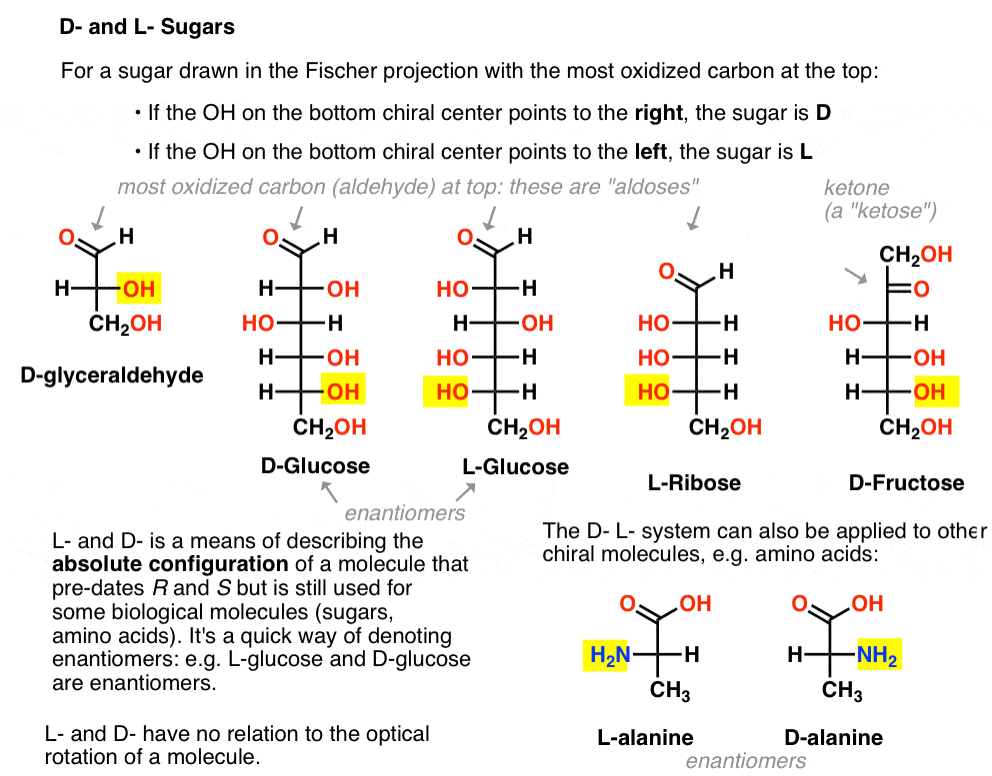
Tato terminologie může být také aplikován na aminokyseliny: viz L – a D – alaninu na obrázku výše.,
2. Proč Se Obtěžujeme Touto Starou Nomenklaturou?
můžete se oprávněně zeptat: nemáme již systém pro přiřazení absolutní konfigurace ? Proč potřebujeme nový systém?
systém D-L není nový systém, lidi. Je to starý systém-předchází Cahn-Ingold-Prelog.
D-L systém je doslova pozůstatek horse-and-buggy éry, sahající až Emil Fischer práce na sacharidy v pozdních 1800s – v době, kdy organických chemiků měl žádný způsob, jak určit absolutní konfiguraci stereocenters, které bylo možné v roce 1951 (thx, Bijvoet).,
tak proč se stále používá? Nemělo by to být zasíláno do popelnice historie, spolu s pravidly skluzu, 8-track kazety, a 5 ¼ “ diskety?
No, v některých částech venkovské Ameriky existují prosperující komunity, kde přetrvávají koňské povozy – pokud víte, kde hledat. (Možná jednou budou obce, kde lidé používají pouze počítačovou technologii 1970 a 1980?)
podobně existuje kapsa organické chemie, kde systém D-L stále najde použití, a to konkrétně v oblasti cukrů a aminokyselin.,
to není vzpoura Amish chemiků proti modernímu zlu systému CIP, mimochodem. Existují nejméně 3 dobré důvody, v konkrétním případě cukrů a aminokyselin, pro použití L – A D- :
- stručnost. D-glukóza je sakra mnohem rychlejší psát a říkat než (2R,3S,4R, 5R)2,3,4,5,6-pentahydroxyhexanal. L/D – systém umožňuje konfiguraci molekuly s více chirálními centry být shrnuty s jedním písmenem (plus jeho společný název, samozřejmě – díky Noel pro připomenutí)
- Více stručnost., Stává se to rychlý způsob, jak odkazovat na enantiomery. Enantiomer l-glukózy je D-glukóza. Enantiomer L-tryptofanu je D-tryptofan. A když jsme mohli využít ( + ) nebo (–)- předpony pro rozlišení dvou enantiomerů v poměru glukózy a jiných cukrů, znaménko optické rotace se může lišit s rozpouštědla, teploty, koncentrace a dalších faktorů, což je méně než ideální. Plus, L – a D – odkazovat konkrétně na absolutní konfiguraci, zatímco (jak jsme uvedli dříve) neexistuje žádný jednoduchý vztah mezi znaménko optické rotace a konfigurace.,
- ukazuje se, že většina přirozeně se vyskytujících cukrů je D-a většina přirozeně se vyskytujících aminokyselin je L- . V tomto prohlášení je komprimováno obrovské množství informací a neexistuje žádný konkurenční systém (R/S,+/–), který by mohl nahradit L – A D – jediným znakem. Poznámka
nese opakování: s cukry a aminokyselinami mohou být L – A D – užitečná označení. U jiných molekul na to můžete do značné míry zapomenout.
Co je to D – / L-systém a jak se tyto pojmy vztahují ke struktuře?,
Připojte se ke mně, jak budeme cestovat zpět v čase…
L – A D – Systém Pro Přiřazení „Absolutní Konfiguraci“
Emil Fischer začal studovat sacharidů v pozdní 1880. To bylo známo, v té době (pomocí Van ‚ t Hoff), že uhlík byl čtyřboká, a to bylo také známo, že molekuly obsahující uhlík se čtyřmi různými substituenty může otáčet rovinu polarizovaného světla (např. Pasteur). Co nebylo známo, byla absolutní konfigurace některého z chirální molekuly – co bychom odkázat do dnes jak jejich „R“ a „S“ konfigurací.,
nejjednodušší sacharid obsahující chirální centrum je glyceraldehyd, C3H6O3. Glyceraldehyd má tři uhlíky; což je „triosa“. Nejvíce oxidovaný uhlík v glyceraldehydu je aldehyd, který z něj také činí „aldózu“.
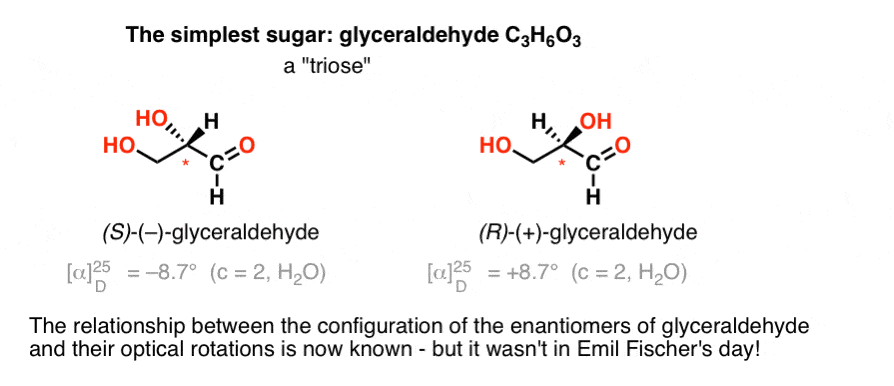
v roce 1888 byly izolovány a charakterizovány dva enantiomery glyceraldehydu., Protože ale neexistuje žádná jednoduchá korelace mezi konfigurace chirální centrum a směr, ve kterém se to otáčí rovinu polarizovaného světla, Emil Fischer měl žádný způsob, jak vázání zpět optická otáčivost (+)- a (–)-glyceraldehyd k absolutní konfigurace atomů kolem chirální centrum.
pomocí dnešní terminologie neměl možnost zjistit, zda ( – ) – glyceraldehyd byl (R) nebo (S).
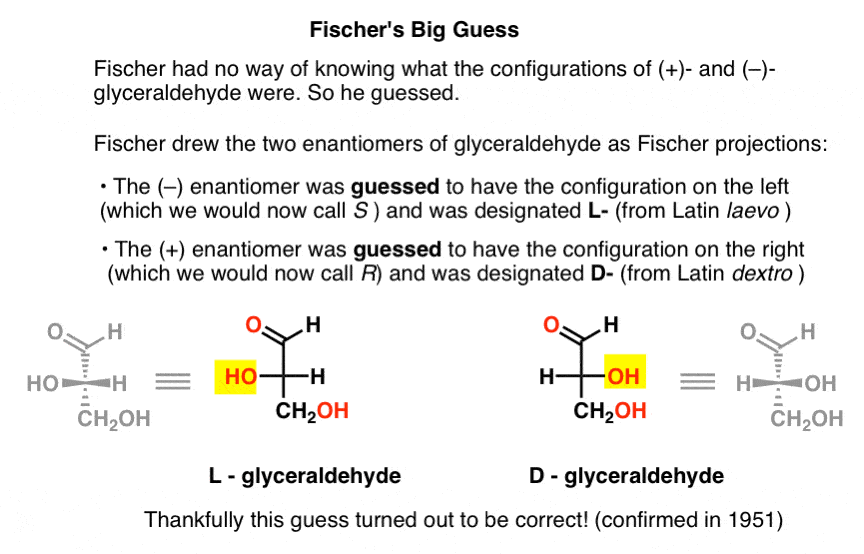
chybí tato klíčová informace, Fischer se rozhodl hádat.,
odhadnout, což se ukázalo být správné, bylo, že (–)-glyceraldehyd měl konfiguraci jsme teď zavolat, S, a, že (+)-glyceraldehyd má konfigurace nyní nazýváme R.
samozřejmě, Cahn, Ingold a Prelog nebyl tehdy ještě na světě, a CIP systém by měl být vypracován pouze po Bijvoet práce v roce 1951. Takže Fischer vyvinul vlastní nomenklaturu.
Kreslení glyceraldehyd v to, co bylo později nazváno Fischer projekce, přidělil konfiguraci na levé straně (–)-glyceraldehyd, a nazval L- (zkratka pro latinské levo )., Poté přidělil konfiguraci vpravo na (+)- glyceraldehyd a nazval ji D – (pro Latinskou dextro ).
proč je to tak důležité?
Přiřazení absolutní konfiguraci L – a D – glyceraldehyd byl trochu jako přiřazení Nultý Poledník (0° délky) Královská Observatoř v Greenwich, Anglie., Stejně jako délka každé jiné místo na zemi by pak mohl být stanoven vzhledem k tomuto bodu, pokud jejich relativní vzdálenosti byly známé absolutní konfigurace každé jiné stereocenter by pak mohla být určena, pokud jeho konfigurace vzhledem k L – nebo D – glyceraldehyd byl známý.
to nemusí být nejjasnější analogie. Podívejme se tedy na 4-uhlíkové cukry pro další příklad.,
Čtyři Uhlík Aldehydu D – a L – Cukry (Aldotetroses)
Jednou absolutní konfigurace L – a D – glyceraldehyd byly navrženy, absolutní konfigurace dalších chirálních sloučenin by pak mohly být stanoveny obdobně (a mnoho chemických špinavou práci).
pro dnešek to není rozhodující, ale pro příklad tohoto druhu uvažování, viz toto .
zpět když byl zaveden koncept chirálních Center, pravděpodobně jste se dozvěděli, že molekula s chirálními centry n bude mít stereoizomery 2N (pokud neexistují žádné meso sloučeniny).,
existují dvě čtyři uhlíkové aldózy, threose a erythrose. Každý z nich má dvě chirální centra. Každá z nich existuje jako dvojice enantiomerů (L – A D -), které poskytují celkem čtyři stereoizomery.
zde jsou. Důležité poznámka: na obrázku níže je to, že L-rodina cukrů má OH skupinu spodní chirální uhlík na levé straně, a D-rodina má OH skupinu spodní chirální uhlík vpravo (zvýrazněno).,
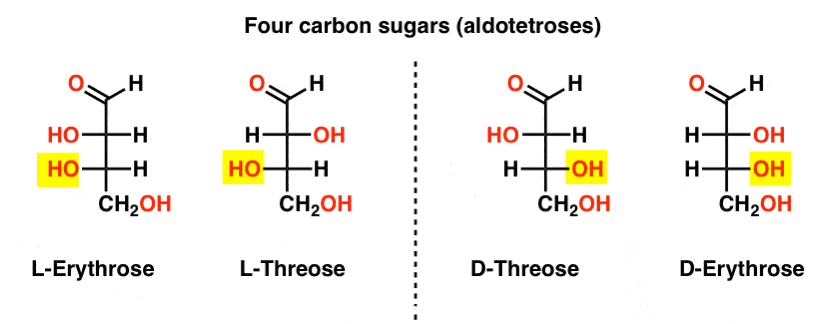
Podívejte se, jak L-Erythrose a L-Threose stavět na stereocenter sídlem v L-glyceraldehyd (zvýrazněné), a D-Erythrose a D-Threose stavět na stereocenter založena v D-glyceraldehyd (zvýrazněné).
cukry jsou vytvářeny trochu jako binární systém; můžete si myslet, že každé stereocenter je „bit“, který může mít jednu ze dvou hodnot. Konfigurace L-erythrose a L-threose se liší pouze u jednoho stereocentra. Kdybychom otočili pozici H A OH, dostali bychom druhou., Tento vztah má název, který jste mohli vidět někdy: dvě molekuly, které mají opačnou konfiguraci pouze na jeden stereocenter se nazývají epimers, zvláště když jeden z atomů připojených k stereocenter je vodík (H).
pět uhlíkových aldehydů D-A L-cukrů (Aldopentózy)
nejznámějším názvem na tomto seznamu by měla být ribóza, což je cukrová páteř ribonukleové kyseliny (RNA).
na levé straně v níže uvedeném diagramu máme l-aldopentózy, které všechny sdílejí stejnou konfiguraci spodního stereocentra, když je aldehyd umístěn nahoře.,
jejich enantiomery, d-aldopentózy, jsou na pravé straně, které všechny sdílejí stejnou konfiguraci spodního stereocentra (zvýrazněné).
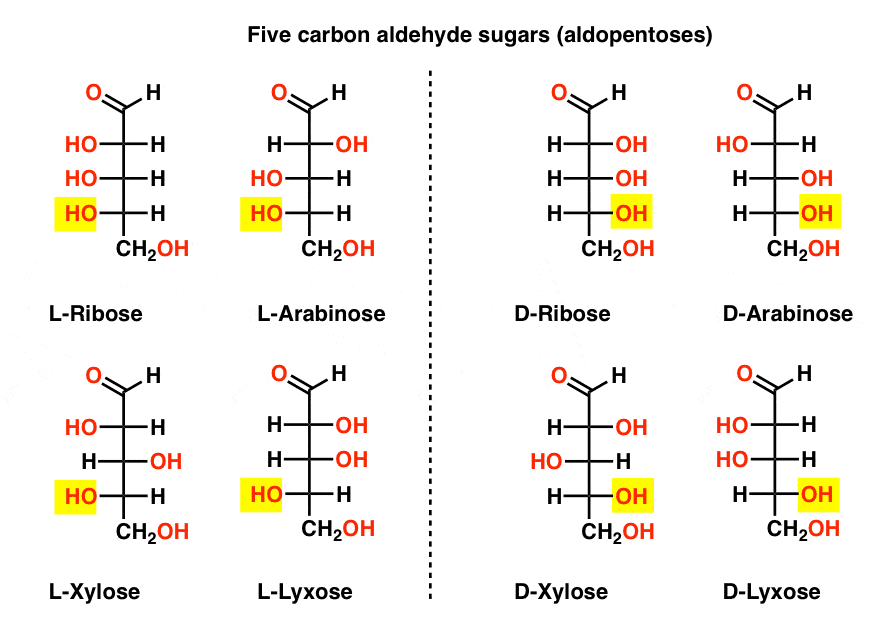
Na tomto místě bychom měli zdůraznit, že drtivá většina cukrů v Zemi-založené formy života jsou D – cukry, včetně D-ribóza jako páteř RNA. Proč a jak všechny organismy na zemi skončily s d-cukry, je záhadou, jak se předpokládá, že L-cukry by fungovaly stejně dobře.,
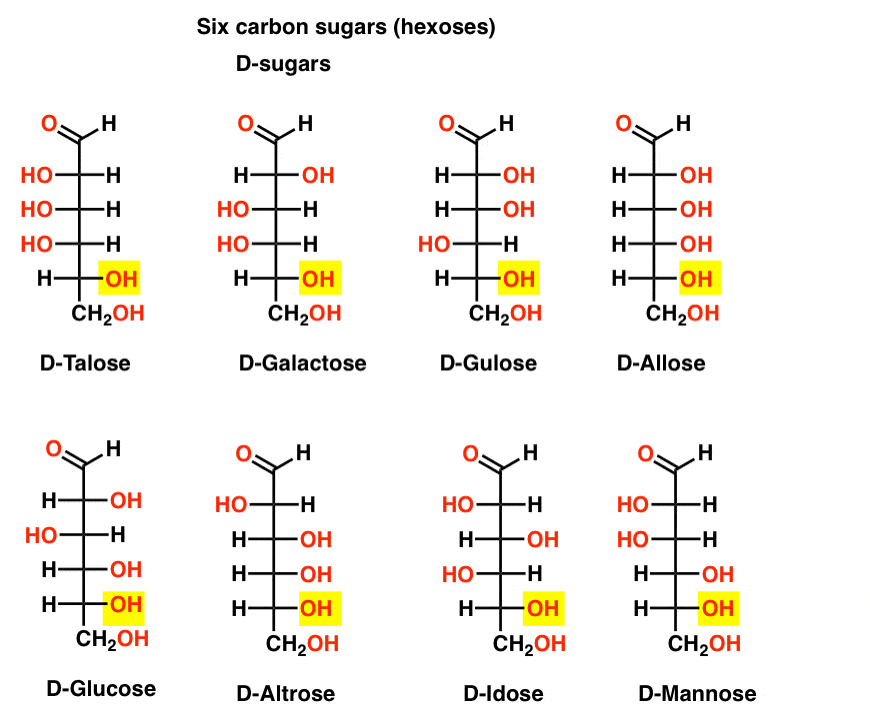
šest uhlíkových aldehydů D-A L-cukrů (Aldohexózy)
pokud existují 4 aldopentózy, každý jako D – L – pár enantiomerů (celkem 8 stereoizomerů), kolik aldohexóz je tam?
existuje 8 d-l-párů (celkem 16 stereoizomerů). Nejznámější je glukóza, ale pravděpodobně poznáte manózu a galaktózu. Některé jsou zřídka, pokud vůbec, nalezené v přírodě (idose, někdo?).
zde jsou D-aldohexózy. Všimněte si, jak všichni mají stejnou konfiguraci spodní chirální centrum – stejné jsme viděli v D-glyceraldehyd.,
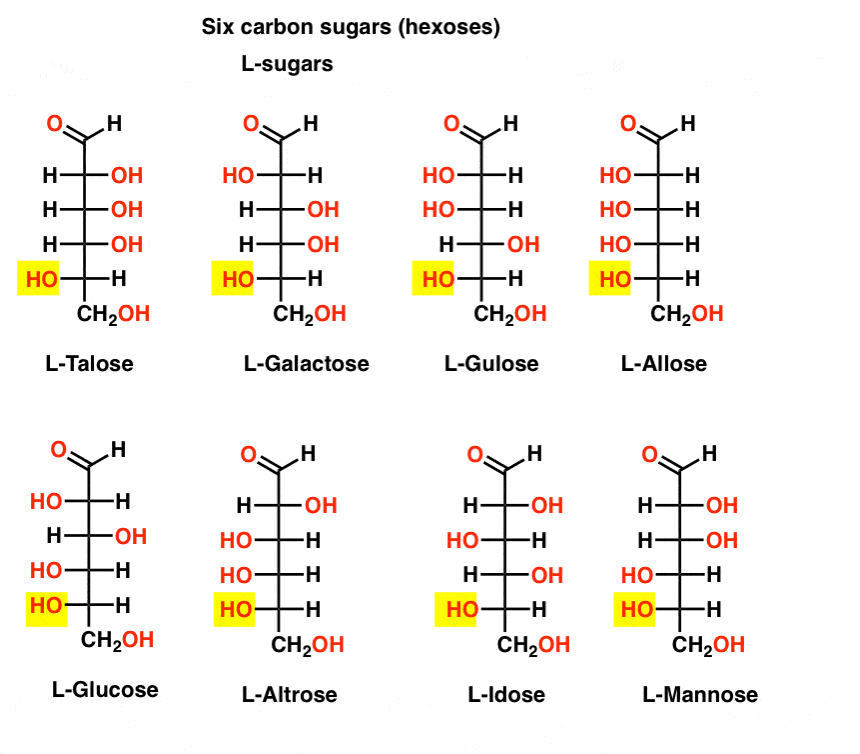
Na rozdíl od D – cukrů se l-cukry (níže) vyskytují v přírodě jen zřídka. Zajímavé je, že l-glukóza byla prozkoumána jako náhražka cukru. Jeho chuť je nerozeznatelná od přirozeně se vyskytující D-glukózy, ale neposkytuje žádnou výživu, protože ji nelze rozkládat našimi (chirálními) enzymy. Jak se ukazuje, výroba je prostě příliš drahé konkurovat splenda, stevia, aspartam et. Ala.
OK, to stačí. Byly vyrobeny sedm uhlíkové cukry (aldoheptózy), ale nejsou biologicky významné.,
7. Ale počkejte-je toho víc! (Aminokyselin)
Pokud nakreslíte aminokyselin v Fischerova projekce se nejvíce oxiduje skupina na vrcholu (karboxylové kyseliny) pak můžete přiřadit také L – a D-.
z 19 chirálních aminokyselin, které jsou začleněny do proteinů (proteinogenní je správný termín )jsou všechny L -. (Glycin je achirální, takže D – A L-neplatí). Některé D-aminokyseliny se přirozeně vyskytují, ale jsou vzácné (většinou se vyskytují v bakteriích, s pozoruhodnou výjimkou ptakopyskového jedu) a nejsou kódovány mRNA.,
je zajímavé, že ačkoli všech 19 chirálních aminokyselin je L -, pouze 18 z 19 Je (jsou). Jaká je výjimka?
(to je dobrá organická chemie bar trivia).
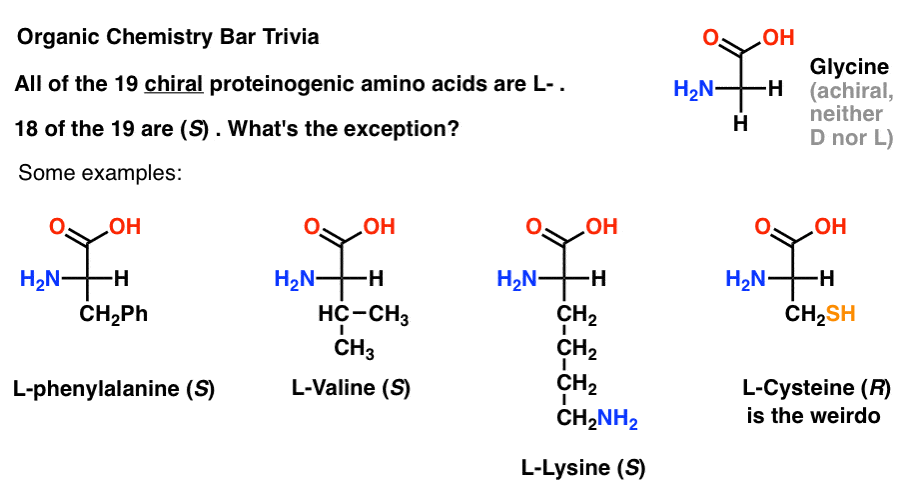
cystein je podivín.
(bonusové body, pokud jste také řekl selenocysteine … nerd).
souhrn: D-A L-notace pro cukry a aminokyseliny
tak to je D – L – systém pro přiřazení absolutní konfigurace. Funguje to dobře pro cukry, protože mohou být budovány tak systematicky (jako binární systém). Je také užitečné pro aminokyseliny., Klíčovým bodem je jen podívat se na spodní stereocentrum, zatímco je nakresleno ve Fischerově projekci. Že? D. Vlevo? L.
cukry samozřejmě nejsou vždy tak užitečně kresleny ve Fischerových projekcích-tvoří kroužky. Budeme psát o určení D – A L-v cyklických cukrů v budoucím příspěvku.
vše, co musím říci, je, děkuji, ať už se rozhodnete věřit v to, že Fischerův odhad se ukázal být správný. To by byla obrovská osina v zadku, aby prosít přes 70+ let z chemické literatury s vědomím, že špatné konfigurace byla přiřazena všechny cukry a aminokyseliny.,
díky Thomas Struble za pomoc s tímto příspěvkem.
poznámky
Poznámka 1. „předposlední stereocenter v nejvíce chirální cukrů je R, zatímco stereocenter v většina aminokyselin je S“ nemá tak dobrý zvuk, zejména proto, cystein je R.]
Poznámka:. Zde je myšlenkový experiment pro určení relativních konfigurací erythrose a threose., (Říkám „myšlenkový experiment“, protože nechci, aby obsahovaly specifická činidla, které by mohly být rušivé)
Pokud se jedna začíná čistého (+)-erythrose a dochází k oxidaci primárního alkoholu na aldehyd pomocí známých metod, se získá sloučenina chybí jakékoliv optické rotace. Totéž platí pro ( – ) – erythrose, která vrací zcela identickou sloučeninu. Z toho lze vyvodit, že struktura nové sloučeniny, musí být takové, že molekula má vnitřní rovinu zrcadlení (tj. mezo). .,
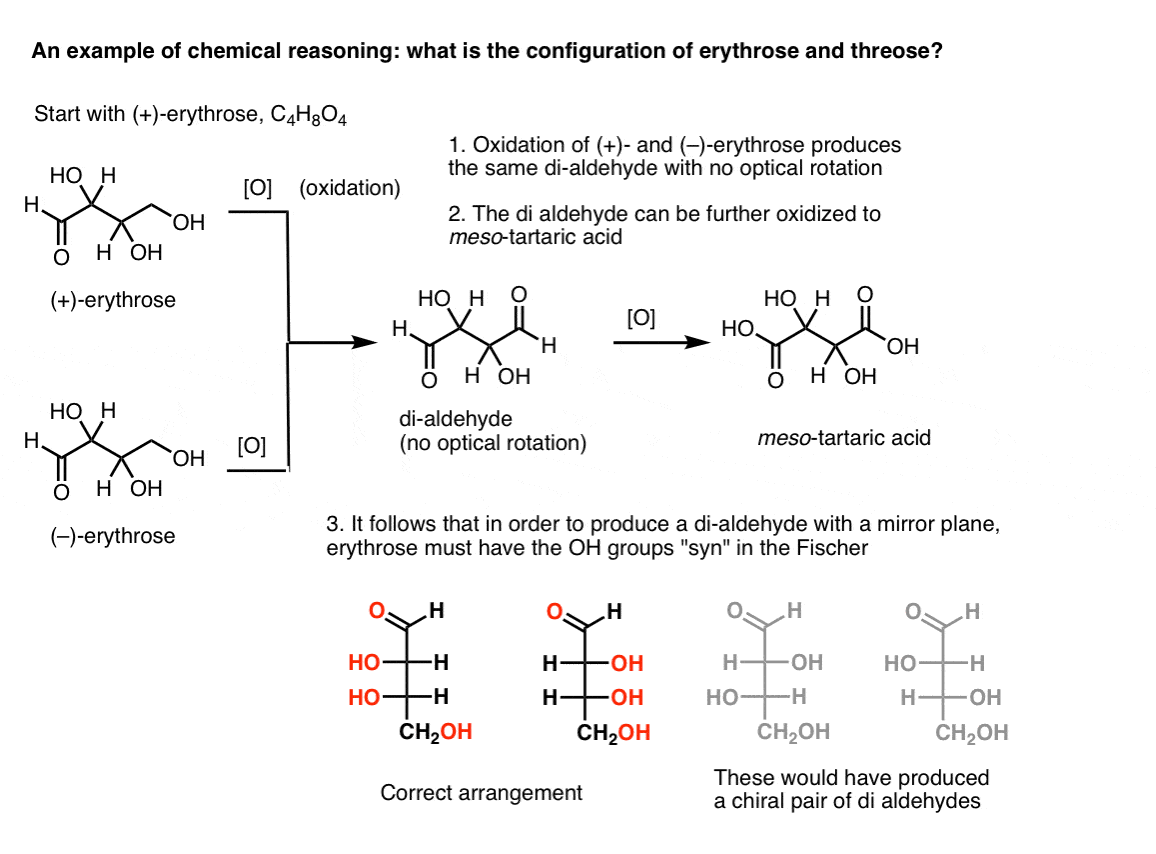
V kontrastu, provedení stejné operace na (+)-threose výsledky v di-aldehyd, který udržuje optické rotace. Sloučenina se stejnou a opačnou optickou rotací je tvořena provedením stejné operace na (- ) – trojici. Tyto dvě sloučeniny jsou enantiomery. Aby to byla pravda, musí být relativní orientace hydroxylových skupin v threose anti. Tyto sloučeniny mohou být dále oxidovány za vzniku ( – ) – a ( + ) – kyseliny vinné.,
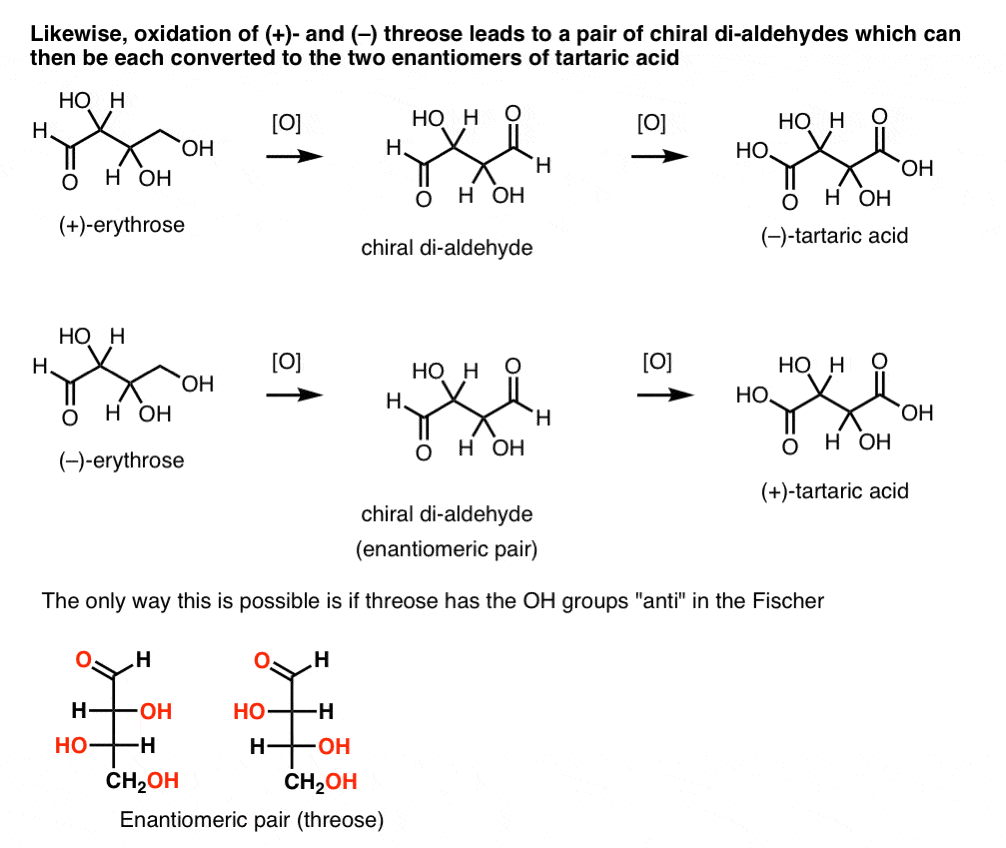
stejné uvažování lze použít v opačném směru (redukce). Například ( + ) – nebo ( – ) – erythrose může být redukován na tetra-ol erythritol, což je meso.
podobně snížení ( + ) – a ( – ) threózy vede k enantiomerickému páru tetra-ols, threitolu.
z těchto skutečností můžeme odvodit relativní orientaci OH skupin.
(Pokročilé) Odkazy a Další Čtení
- Über die Bezeichnung von optischen Antipoden durch die Buchstaben d a l
Emil Fischer
Ber. 1907, 40 (1), 102-106
DOI: 10.,1002 / sber.19070400111
Toto je slavný dokument, kde Prof. Emil Fischer (svévolně!) přiřazen ( – ) – glyceraldehyd l-stereochemie. - Shrnutí v Purinových a Cukru Skupiny
Emil Fischer
Nobelova Přednáška, 1902Fischer je Nobelova Přednáška, kde mluví o své práci nejen na sacharidy, ale také na puriny, z nichž látek, jako jsou kofein a theobromin jsou členy. Prof. Fisher předpovídá vzestup energetických nápojů (např., Red Bull), uvádějící, že „s výkonem trochu představivosti den, lze předvídat, když fazole nebude nutné, aby se dobré kávy: malé množství prášku z chemického pracuje společně s vodou bude poskytovat pikantní, osvěžující nápoj překvapivě levně“.
- stanovení absolutní konfigurace opticky aktivních sloučenin pomocí rentgenových paprsků
BIJVOET, J., PEERDEMAN, a. & van BOMMEL, a.,
Příroda 1951, 168, 271-272
DOI: 1038/168271a0
slavný papír, který ukázal, pomocí X-ray strukturální analýza, že „Emil Fischer úmluvy, který je přidělil konfiguraci Obr. 2 na kyselinu dextrorotační, zdá se, že odpovídá skutečnosti“. - Emil Fischer ‚ s discovery of the configuration of glucose. Semicentennial retrospect
C. S. Hudson
Journal of Chemical Education 1941, 18 (8), 353
DOI: 10.1021/ed018p353
raná recenze, která se týká práce Prof. Emila Fischera v chemii sacharidů., - důkaz Emila Fischera o konfiguraci cukrů: sté výročí Hold
Frieder W. Lichtenthaler
Angew. Chem. Int. EDA. 1992, 31 (12), 1541-1556
DOI: 10.1002/anie.199215413
velmi čitelná recenze z roku 1992, která pokrývá práci Prof. Fischera v chemii sacharidů a jde do hloubky do stereochemických přiřazení sacharidů.
