Úvod do karbonylové skupiny,
V organické chemii, karbonylová skupina je funkční skupina, kde uhlíku a atom kyslíku jsou spojeny s manželskou dluhopisů. Sloučeniny obsahují karbonylovou skupinu známou jako karbonylové sloučeniny. Karbonylová skupina označuje oxid uhelnatý, který může být také připojen k anorganickému atomu jako ligand, který se nazývá kovový karbonyl, např.,
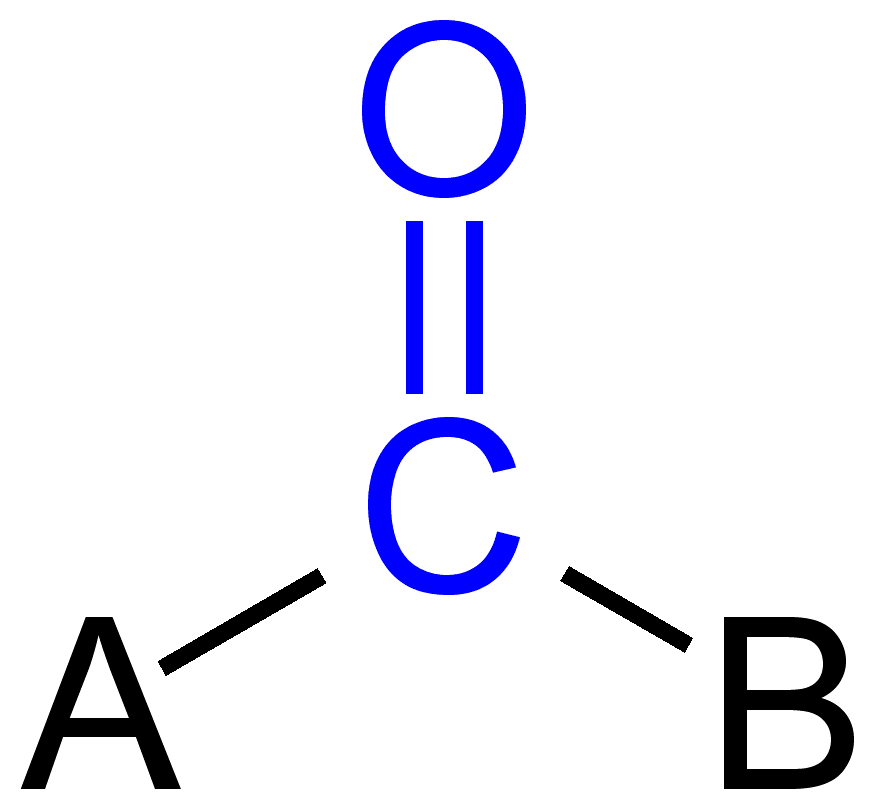
Některé karbonylové skupiny,
dvojné vazby v karbonylové skupině,
uhlíku a atom kyslíku v karbonylové skupině jsou obvykle sp2 hybridizace, a proto plannar. Vzhledem k přítomnosti kyslíku jako elektronegativního atomu je dvojná vazba v karbonylové skupině odlišná od dvojné vazby v alkenech z hlediska reaktivity. Vzhledem k větší elektronegativitě a přítomnosti dvou osamělých elektronů se kyslík stává částečně záporným nábojem, zatímco karbonyl uhlík generuje částečně pozitivní náboj a tím je pozorována polarita.,
karbonylová rezonanční struktura
vzhledem k přítomnosti kyslíku jako elektronegativního atomu vykazuje karbonylová skupina rezonanční strukturu. Rezonanční struktura karbonylové skupiny ovlivňuje reaktivitu sloučeniny. Více elektronegativní atom kyslíku přitahuje pryč elektron od uhlíku centrum je karbonylu oxid částečně elektropozitivní a kyslík částečně elektronegativní. Polarita tak vzniká v karbonylové sloučenině.
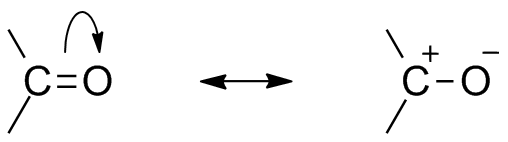
Tento elektropozitivní uhlíku karbonylové nebo elektrofilem nyní můžete být napadeni nukleofil.,
Reaktivita
Karbonylové Alkylace
Alkylaci karbonylové skupiny nucleophilic kromě reakce s použitím Grignardova činidla jsou zobrazeny takto:

Fyzikální vlastnosti karbonylových sloučenin,
- bod varu aldehydy a ketony jsou vyšší, než je bod varu etherů a alkany o podobné molekulové hmotnosti.
- teplota varu aldehydů a ketonů je opět nižší než odpovídající alkoholy.,
- mnoho vyšších aldehydů má příjemný zápach a používá se v parfémech nebo jako umělá příchuť, zatímco nižší člen jejich homologní řady má štiplavý zápach.
- vyšší ketony mají nevýrazný zápach a nižší mají příjemný zápach, jako je aceton.
- malé aldehydy a ketony jsou rozpustné ve vodě, ale jak se délka řetězce zvyšuje, rozpustnost klesá.
- disperzní síly van der Waals zesilují, jak se molekuly prodlužují.,
H-vazby v karbonylové skupině, skupinovou
z Důvodu vzniku H-vazby mezi karbonylové kyslíku a vodíku z molekuly vody, tím nižší karbonylové sloučeniny jsou rozpustné ve vodě. Ale jak se řetězec zvyšuje, přichází na cestu k vytvoření vodíkové vazby a rozpustnost klesá.
van der Waals dipól-dipólová přitažlivost
kvůli polaritě v karbonylové skupině a přítomnosti disperzních sil bude přitažlivost mezi dvěma blízkými molekulami. To způsobuje, že bod varu karbonylových sloučenin je vyšší než odpovídající alkany., V následující tabulce si všimněte, že bod varu karbonylových sloučenin je vyšší než odpovídající alkany a nižší než alkoholy.,v>Boiling point (o C)
Spectroscopy
Infrared spectroscopy
The absorption of carbonyl group depends on the geometry of the molecule., Obvykle absorpci infračervené světlo ukazuje na vlnočtu přibližně 1600 až 1.900 cm−1 (5263 nm až 6250 nm).
nukleární magnetická rezonance
uhlík-NMR karbonylového uhlíku vykazuje vrchol přibližně mezi 160-220 ppm.
