příklad-předpovídání molekulární Polarity:
Rozhodnouzda molekuly reprezentované následujícími vzorci jsou polární ornonpolární. (Možná budete muset nakreslit Lewisovy struktury a geometrické náčrtky do doso.)
. CO2 b. Z2 c. CCl4 d. CH2Cl2 e. HCN
Řešení:
. Lewis struktura pro CO2 je
electronegativities uhlíku a oxygenare 2.55 a 3.44. The 0.,89 rozdíl v elektronegativitě naznačuje, že vazby theC-O jsou polární, ale symetrické uspořádání těchto vazeb činí molekulu nepolární.
Pokud vložíme šipky do geometrického náčrtu pro CO2, vidíme, že se přesně vyrovnávají, v obou směrech amagnetismus. To ukazuje symetrii vazeb.
b., Lewis struktura pro Z2
electronegativities kyslíku a fluoru,3.44 a 3.98, v tomto pořadí, produkují 0.54 rozdíl, který nás vede k predictthat Z dluhopisů jsou polární. Molekulární geometrie OF2 je ohnutá. Asymetrická distribuce polárních vazeb by vytvořila polární molekulu.
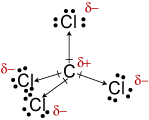
c. Molekulární geometrie CCl4 istetrahedral., I když jsou vazby C-Cl polární, jejich symetrické uspořádánídělá molekulu nepolární.
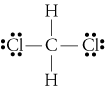
d. TheLewis strukturu pro CH2Cl2 je
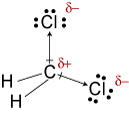
electronegativities z vodíku, uhlíku, andchlorine jsou 2.20, 2.55, a 3.16. Rozdíl 0,35 v elektronegativitě proplatky H-C nám říkají, že jsou v podstatě nepolární. The 0.,61rozdíl v elektronegativitě pro vazby C-Cl ukazuje, že jsoupolární. Následující geometrické náčrty ukazují, že polární vazby jsousymetricky uspořádané, takže molekula je polární. (Všimněte si, že výše uvedená Lewisstruktura nesprávně naznačuje, že vazby jsou symetricky uspořádány.Mějte na paměti, že Lewisovy struktury často vyvolávají falešný dojem geometriemolekul, které představují.)

e., TheLewis struktura a geometrické skici pro HCN jsou stejné:
electronegativities z vodíku,uhlíku a dusíku jsou 2.20, 2.55, a 3.04. Rozdíl 0,35 velektronegativita pro vazbu H-C ukazuje, že je v podstatě nepolární. Rozdíl 0. 49 v elektronegativitě pro vazbu C-N nám říká, že je polární.Molekuly s jednou polární vazbou jsou vždy polární.