Die D – Und L-Notation für die absolute Konfiguration von Zuckern Und Aminosäuren
Was unterscheidet „D-Glucose „von“ L-Glucose“? Oder D-Alanin aus L-Alanin?
Und was ist diese D – und L – Nomenklatur überhaupt? Weiterlesen:
Inhaltsverzeichnis
- D – und L – Bietet eine Schnelle Abkürzung für Die Bezeichnung Von Enantiomeren
- Warum kümmern wir uns um Diese Alte Nomenklatur?,
- Das L – Und D-System zur Zuordnung der „Absoluten Konfiguration“
- Vier-Kohlenstoff-Aldehyd-D – und L – Zucker (Aldotetrosen)
- Fünf-Kohlenstoff-Aldehyd-D – und L – Zucker (Aldopentosen)
- Sechs-Kohlenstoff-Aldehyd-D – und L – Zucker (Aldohexosen)
- Aber Warten Sie-Es gibt noch mehr! (Aminosäuren)
- Zusammenfassung: D – und L – Notation für Zucker und Aminosäuren
- Anmerkungen
- (Fortgeschrittene) Referenzen und weitere Lektüre
D – Und L – Bietet eine schnelle Kurzschrift für die Bezeichnung von Enantiomeren
D – und L – Notation bietet eine schnelle Kurzschrift für die Bezeichnung von Enantiomeren.,
D-Glucose ist beispielsweise das Enantiomer von L-Glucose. Da L-Alanin das Enantiomer von D-Alanin ist.
Es wird wie folgt zugewiesen. Für einen Zucker, der in der Fischer – Projektion mit dem am stärksten oxidierten Kohlenstoff an der Oberseite (d. H. Aldehyd oder Keton) gezogen wird
- wenn das OH am unteren chiralen Zentrum nach rechts zeigt, wird es als D –
- bezeichnet Wenn das OH am unteren chiralen Zentrum nach links zeigt, wird es als L-bezeichnet .
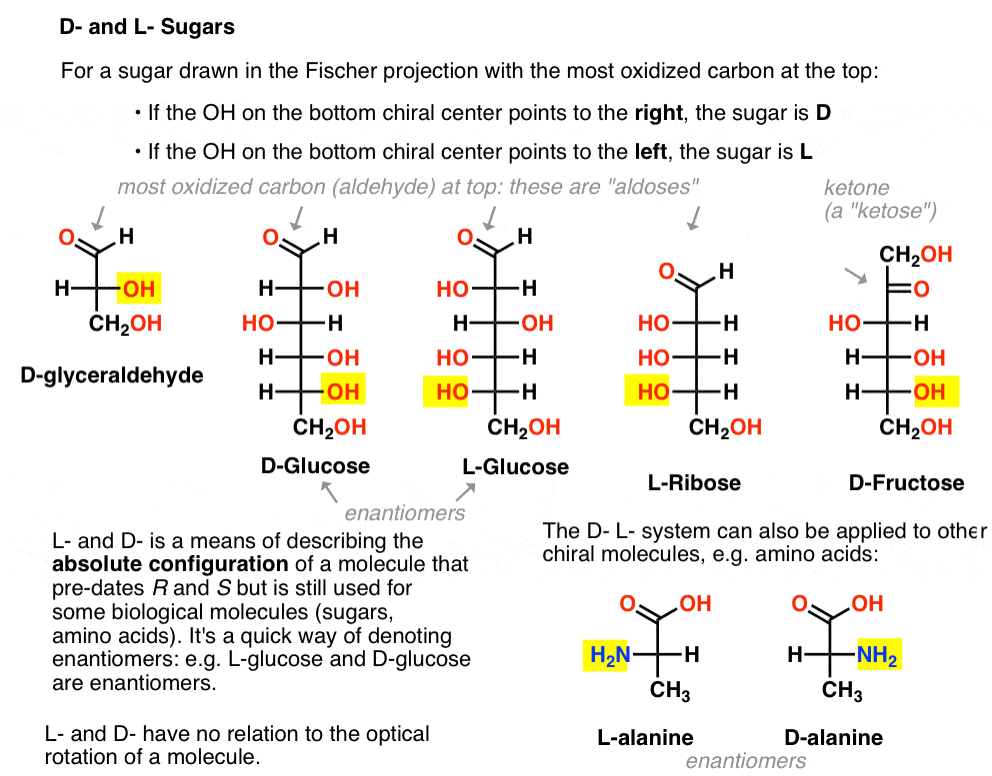
Diese Terminologie kann auch auf Aminosäuren angewendet werden: siehe L – und D – Alanin im Bild oben.,
2. Warum Kümmern Wir Uns Um Diese Alte Nomenklatur?
Sie könnten zu Recht fragen: Haben wir nicht bereits ein System zur Zuweisung absoluter Konfiguration ? Warum brauchen wir ein neues system?
Das D-L-System ist kein neues System, Leute. Es ist das alte System-es ist älter als Cahn-Ingold-Prelog.
Das D-L-System ist buchstäblich ein Überbleibsel der Pferde-und Buggy-Ära, die auf Emil Fischers Arbeit an Kohlenhydraten in den späten 1800er Jahren zurückgeht – eine Zeit, in der organische Chemiker keine Möglichkeit hatten, die absolute Konfiguration von Stereocentern zu bestimmen, was erst 1951 möglich wurde (thx, Bijvoet).,
Warum wird es also immer noch verwendet? Sollte es nicht in den Mülleimer der Geschichte geschickt werden, zusammen mit Folienregeln, 8-Spur-Kassetten und 5 ¼ “ Disketten?
Nun, es gibt blühende Gemeinschaften in Teilen des ländlichen Amerikas, in denen Pferdekutschen bestehen bleiben-wenn Sie wissen, wo Sie suchen müssen. (Vielleicht wird es eines Tages Gemeinden geben, in denen Menschen nur Computertechnologie der 1970er und 1980er Jahre verwenden?)
Ebenso gibt es eine Tasche der organischen Chemie, wo D-L-System noch Verwendung findet, und das ist speziell im Bereich der Zucker und Aminosäuren.,
Dies ist übrigens kein Aufstand der Amish-Chemiker gegen die modernen Übel des CIP-Systems. Es gibt mindestens 3 gute Gründe, im speziellen Fall von Zuckern und Aminosäuren, L – und D – zu verwenden :
- Kürze. D-Glucose ist viel schneller zu schreiben und zu sagen als (2R,3S,4R,5R)2,3,4,5,6-Pentahydroxyhexanal. Das L- / D – System ermöglicht die Konfiguration eines Moleküls mit mehreren chiralen Zentren, die mit einem einzigen Buchstaben zusammengefasst werden können (plus seinem gemeinsamen Namen, natürlich – dank Noel für die Erinnerung)
- Mehr Kürze., Es ist zufällig eine schnelle Art, sich auf Enantiomere zu beziehen. Das Enantiomer von L-Glucose ist D-Glucose. Das enantiomer von L-tryptophan ist D-tryptophan. Und während wir die (+)- oder (–)- Präfixe verwenden könnten, um die beiden Enantiomere von Glukose und anderen Zuckern zu unterscheiden, kann das Zeichen der optischen Rotation mit Lösungsmittel, Temperatur, Konzentration und anderen Faktoren variieren, was es weniger als ideal macht. Außerdem beziehen sich L – und D – speziell auf die absolute Konfiguration, während (wie bereits erwähnt) keine einfache Beziehung zwischen dem Vorzeichen der optischen Rotation und der Konfiguration besteht.,
- Es stellt sich heraus, dass die meisten natürlich vorkommenden Zucker D-und die meisten natürlich vorkommenden Aminosäuren L – sind . In dieser Anweisung ist eine enorme Menge an Informationen komprimiert, und es gibt kein konkurrierendes System (R/S,+/–), das das L – und D – durch ein einzelnes Zeichen ersetzen könnte. Hinweis
Es wiederholt sich: Mit Zucker und Aminosäuren können L – und D – Bezeichnungen nützlich sein. Für andere Moleküle können Sie es weitgehend vergessen.
Was ist dieses D-/L – System und wie beziehen sich diese Begriffe auf die Struktur?,
Begleiten Sie mich auf einer Zeitreise…
Das L – Und D – System zur Zuweisung der „Absoluten Konfiguration“
Emil Fischer begann Ende der 1880er Jahre mit der Untersuchung von Kohlenhydraten. Zu dieser Zeit (via Van ‚ t Hoff) war bekannt, dass Kohlenstoff tetraedrisch war, und es war auch bekannt, dass Moleküle, die einen Kohlenstoff mit vier verschiedenen Substituenten enthielten, flugzeugpolarisiertes Licht drehen konnten (z. B. Pasteur). Was nicht bekannt war, war die absolute Konfiguration eines der chiralen Moleküle – was wir heute als „R“ – und „S“ – Konfigurationen bezeichnen würden.,
Das einfachste Kohlenhydrat, das ein chirales Zentrum enthält, ist Glyceraldehyd, C3H6O3. Glyceraldehyd hat drei Kohlenstoffe; so dass es eine „Triose“. Der am meisten oxidierte Kohlenstoff in Glyceraldehyd ist ein Aldehyd, der ihn auch zu einer „Aldose“macht.
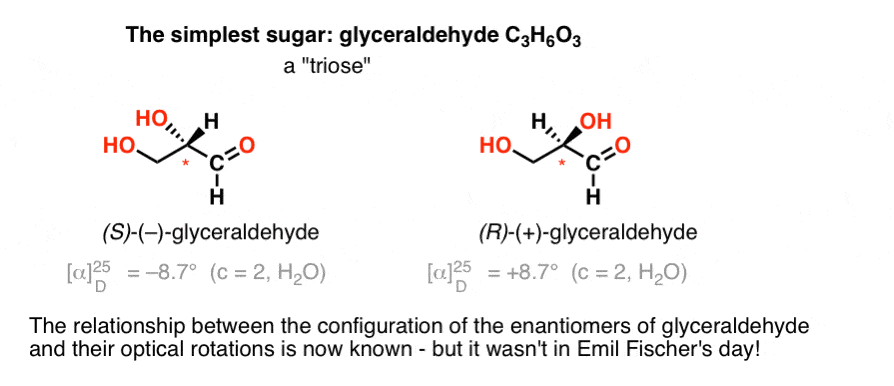
1888 waren die beiden Enantiomere von Glyceraldehyd isoliert und charakterisiert worden., Da es jedoch keine einfache Korrelation zwischen der Konfiguration eines chiralen Zentrums und der Richtung gibt, in der es flugzeugpolarisiertes Licht dreht, hatte Emil Fischer keine Möglichkeit, die optische Rotation von ( + )-und ( – ) –Glyceraldehyd an die absolute Konfiguration der Atome um das chirale Zentrum herum zu binden.
Mit der heutigen Terminologie hatte er keine Möglichkeit zu wissen, ob ( – ) – Glyceraldehyd (R) oder (S) war.
Ohne diese wichtige Information wählte Fischer zu erraten.,
Die Vermutung, die sich als richtig herausstellte, war, dass (- ) – Glyceraldehyd die Konfiguration hatte, die wir jetzt S nennen, und dass (+) – Glyceraldehyd die Konfiguration hat, die wir jetzt R nennen
Natürlich waren Cahn, Ingold und Prelog noch nicht geboren, und das CIP-System würde erst nach Bijvoets Arbeit im Jahr 1951 entwickelt werden. So entwickelte Fischer seine eigene Nomenklatur.
Zeichnen von Glyceraldehyd In der späteren Fischer –Projektion ordnete er die Konfiguration links (- ) – Glyceraldehyd zu und nannte sie L – (kurz für lateinisch laevo )., Er ordnete dann die Konfiguration rechts (+)-Glyceraldehyd zu und nannte es D- (für lateinisches Dextro ).
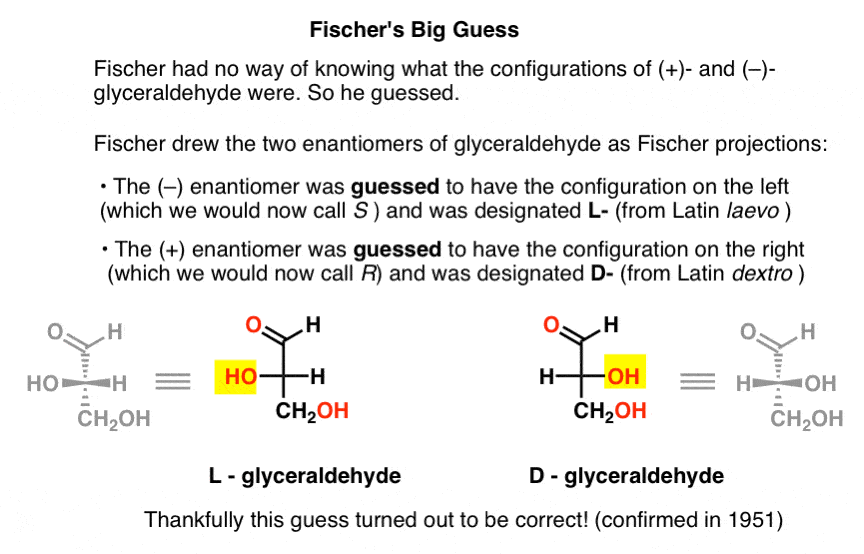
Warum ist das so wichtig?
Die Zuordnung der absoluten Konfiguration für L – und D-Glyceraldehyd war ein bisschen wie die Zuordnung des Primmeridians (0° Längengrad) zum Royal Observatory in Greenwich, England., Genau wie die Länge jedes anderen Ortes auf der Erde dann relativ zu diesem Punkt bestimmt werden könnte, wenn ihre relativen Abstände bekannt wären, könnte dann die absolute Konfiguration jedes anderen Stereozentrums bestimmt werden, wenn seine Konfiguration relativ zu L – oder D – Glyceraldehyd bekannt wäre.
Das ist vielleicht nicht die klarste Analogie. Schauen wir uns also die 4-Kohlenstoff-Zucker für ein anderes Beispiel an.,
Vier Kohlenstoffaldehyd-D – und L – Zucker (Aldotetrosen)
Sobald die absoluten Konfigurationen von L – und D – Glyceraldehyd vorgeschlagen wurden, konnten die absoluten Konfigurationen anderer chiraler Verbindungen analog festgelegt werden (und viel chemische Grunzarbeit).
Es ist nicht entscheidend für heute, aber für ein Beispiel für diese Art von Argumentation, siehe dies .
Als das Konzept der chiralen Zentren eingeführt wurde, haben Sie wahrscheinlich gelernt, dass ein Molekül mit n chiralen Zentren 2n-Stereoisomere haben wird (solange es keine Mesoverbindungen gibt).,
Es gibt zwei Vier-Kohlenstoff-Aldosen, Threose und Erythrose. Sie haben jeweils zwei chirale Zentren. Jedes existiert als ein Paar von Enantiomeren (L-und D -), die insgesamt vier Stereoisomere ergeben.
Hier sind Sie. Die wichtige Sache, die in der Abbildung unten zu beachten ist, ist, dass die L-Familie von Zuckern die OH-Gruppe des unteren chiralen Kohlenstoffs auf der linken Seite hat, und die D-Familie hat die OH-Gruppe des unteren chiralen Kohlenstoffs auf der rechten Seite (hervorgehoben).,
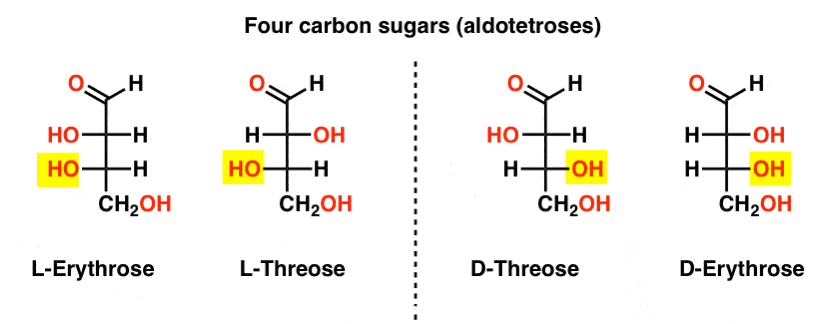
Sehen Sie, wie L-Erythrose und L-Threose auf dem in L-Glyceraldehyd (hervorgehoben) etablierten Stereocenter aufbauen und D-Erythrose und D-Threose auf dem in D-Glyceraldehyd (hervorgehoben) etablierten Stereocenter aufbauen.
Zucker sind ein wenig wie das binäre System aufgebaut; Sie können sich vorstellen, dass jedes Stereocenter ein „Bit“ ist, das einen von zwei Werten haben kann. Die Konfiguration von L-Erythrose und L-Threose unterscheidet sich nur in einem Stereocenter. Wenn wir die Position von H und OH umdrehen würden, würden wir die andere bekommen., Diese Beziehung hat einen Namen, den Sie manchmal sehen können: Zwei Moleküle, die in nur einem Stereocenter die entgegengesetzte Konfiguration haben, werden Epimer genannt, insbesondere wenn eines der Atome, die an das Stereocenter gebunden sind, ein Wasserstoff (H) ist.
Fünf Kohlenstoffaldehyd-D – und L – Zucker (Aldopentosen)
Der bekannteste Name auf dieser Liste sollte Ribose sein, das Zuckerrückgrat der Ribonukleinsäure (RNA).
Auf der linken Seite im Diagramm unten haben wir die L-Aldopentosen, die alle die gleiche Konfiguration des unteren Stereozentrums haben, wenn der Aldehyd oben platziert wird.,
Ihre Enantiomere, die D-Aldopentosen, befinden sich auf der rechten Seite, die alle die gleiche Konfiguration des unteren Stereozentrums aufweisen (hervorgehoben).
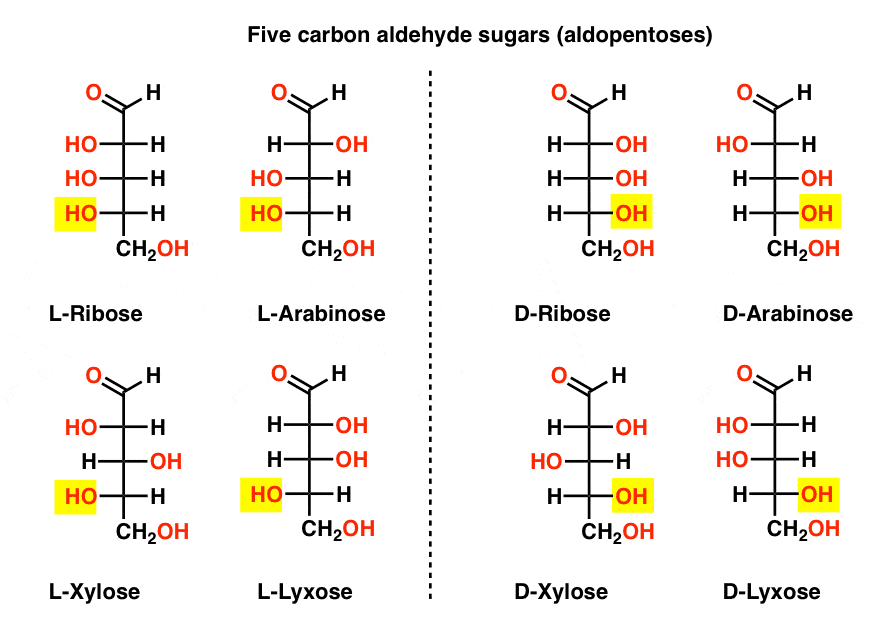
An dieser Stelle sollten wir darauf hinweisen, dass die überwiegende Mehrheit der Zucker in erdbasierten Lebensformen D-Zucker sind, einschließlich D – Ribose als Rückgrat der RNA. Warum und wie alle Organismen auf der Erde mit D-Zucker gelandet sind, ist ein Rätsel, da man davon ausgeht, dass L-Zucker genauso gut funktioniert hätte.,
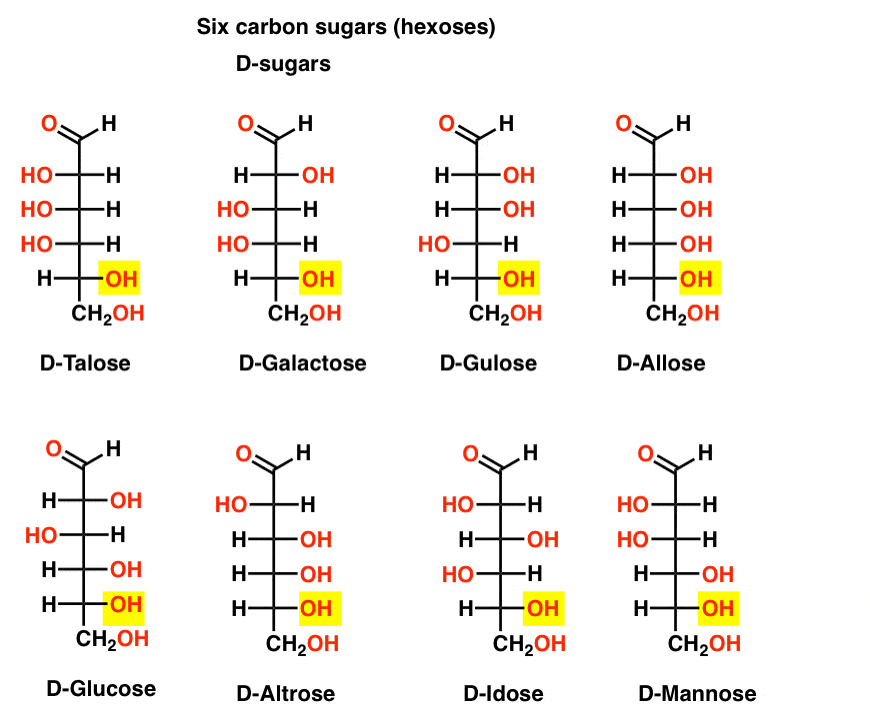
Sechs Kohlenstoffaldehyd-D – und L – Zucker (Aldohexosen)
Wenn es 4 Aldopentosen gibt, jeweils als D-L-Paar Enantiomere (insgesamt 8 Stereoisomere) wie viele Aldohexosen gibt es dann?
Es gibt 8 D-L-Paare (insgesamt 16 Stereoisomere). Das bekannteste ist Glukose, aber Sie werden wahrscheinlich Mannose und Galaktose erkennen. Einige sind selten, wenn überhaupt, in der Natur zu finden (idose, irgendjemand?).
Hier sind die D-Aldohexosen. Beachten Sie, dass sie alle die gleiche Konfiguration des unteren chiralen Zentrums haben – die gleiche, die wir in D-Glyceraldehyd gesehen haben.,
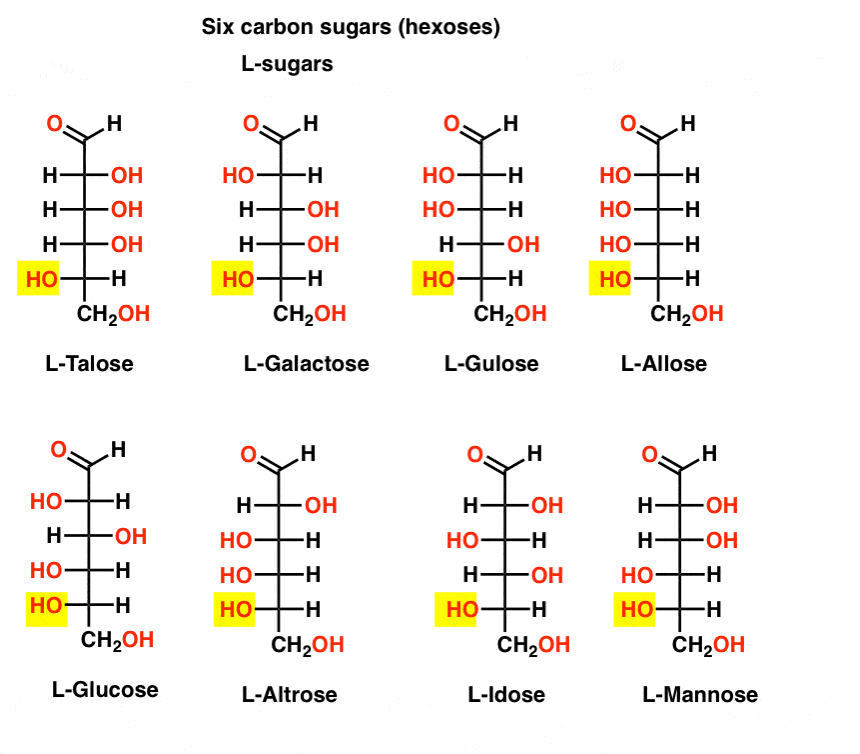
Im Gegensatz zu den D-Zuckern, die L – Zucker (unten) sind selten in der Natur gefunden. Interessanterweise wurde L-Glucose als Zuckerersatz untersucht. Sein Geschmack ist nicht von natürlich vorkommender D-Glukose zu unterscheiden, liefert aber keine Nahrung, da er nicht durch unsere (chiralen) Enzyme abgebaut werden kann. Wie sich herausstellt, ist die Produktion einfach zu teuer, um mit Splenda, Stevia, Aspartam et zu konkurrieren. Al.
OK, das ist genug. Sieben-Kohlenstoff-Zucker wurden hergestellt (Aldoheptosen), aber sie sind nicht biologisch signifikant.,
7. Aber Warte – Es gibt noch mehr! (Aminosäuren)
Wenn Sie Aminosäuren in der oberen Projektion mit der am stärksten oxidierten Gruppe an der Spitze (der Carbonsäure) zeichnen, können Sie auch L – und D-zuweisen.
Von den 19 chiralen Aminosäuren, die in Proteine eingebaut sind (proteinogen ist der richtige Begriff), sind alle L- . (Glycin ist achiral, daher gelten D – und L – nicht). Einige D-Aminosäuren sind natürlich vorkommend, aber sie sind selten (meist in Bakterien gefunden, mit der bemerkenswerten Ausnahme von Schnabelgift) und werden nicht durch mRNA codiert.,
Interessanterweise sind, obwohl alle 19 chiralen Aminosäuren L – sind , nur 18 der 19 (S). Was ist die Ausnahme?
(Dies ist gute organische chemie bar trivia).
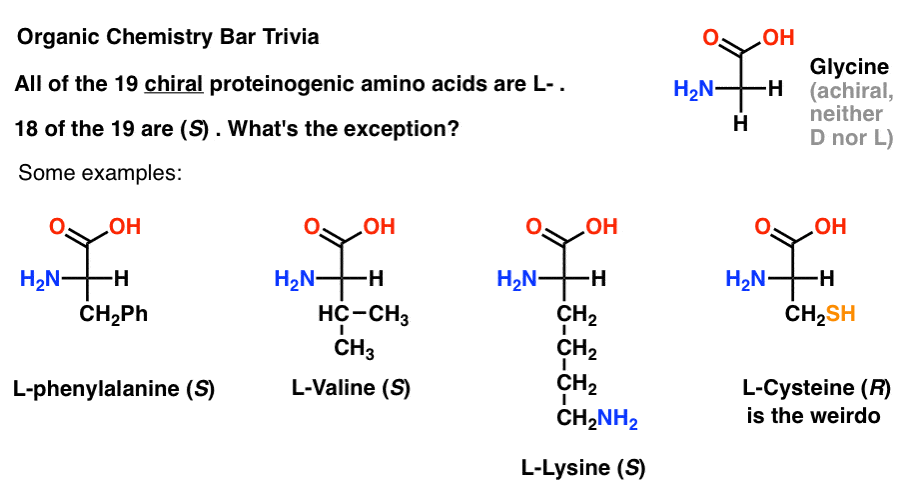
Cystein ist der Spinner.
(Bonuspunkte, wenn Sie sagte auch selenocystein … nerd).
Zusammenfassung: D – und L – Notation für Zucker und Aminosäuren
Das ist also das D-L-System zur Zuordnung der absoluten Konfiguration. Es funktioniert gut für Zucker, da sie so systematisch aufgebaut werden können (wie das binäre System). Es ist auch nützlich für Aminosäuren., Der entscheidende Punkt ist nur, das untere Stereocenter zu betrachten, während es in der unteren Projektion gezeichnet wird. Richtig? D. Links? L.
Natürlich werden Zucker in den Projektionen nicht immer so hilfreich gezeichnet – sie bilden Ringe. Wir werden in einem zukünftigen Beitrag über die Bestimmung von D – und L – in-zyklischen Zuckern schreiben.
Alles, was ich zu sagen habe, ist, danke, welcher Gottheit auch immer Sie glauben, dass Fischers Vermutung richtig war. Es wäre ein enormer Schmerz im Arsch, 70+ Jahre der chemischen Literatur zu durchforsten, in dem Wissen, dass allen Zuckern und Aminosäuren die falsche Konfiguration zugewiesen wurde.,
Danke an Thomas Struble für die Unterstützung bei diesem Beitrag.
Hinweise
Hinweis 1. „das vorletzte Stereocenter in den meisten chiralen Zuckern ist R, während das Stereocenter in den meisten Aminosäuren S ist“ hat nicht ganz den gleichen Ring, zumal Cystein R. ]
Hinweis. Hier ist ein Gedankenexperiment zur Bestimmung der relativen Konfigurationen von Erythrose und Threose., (Ich sage „Gedankenexperiment“, weil ich keine spezifischen Reagenzien einschließen möchte, die ablenken könnten)
Wenn man mit reiner (+)- Erythrose beginnt und den Primäralkohol mit bekannten Methoden zu einem Aldehyd oxidiert, erhält man eine Verbindung ohne optische Rotation. Gleiches gilt für ( – ) – Erythrose, die eine völlig identische Verbindung zurückgibt. Daraus kann abgeleitet werden, dass die Struktur der neuen Verbindung so sein muss, dass das Molekül eine innere Spiegelebene hat (dh es ist Meso). .,
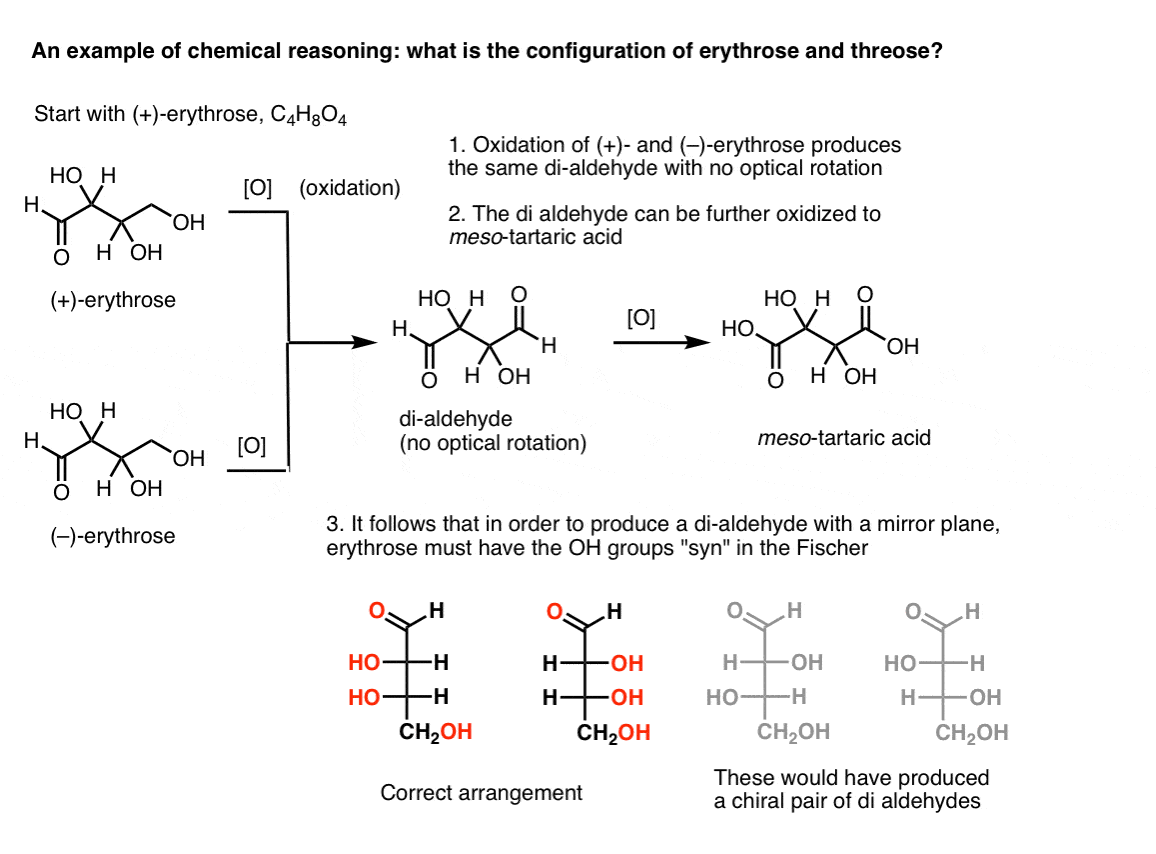
Im Gegensatz dazu führt die gleiche Operation an (+)-Threose zu einem Dialdehyd, der die optische Rotation beibehält. Eine Verbindung mit gleicher und entgegengesetzter optischer Rotation wird gebildet, indem dieselbe Operation an (–)-Threose ausgeführt wird. Diese beiden Verbindungen sind Enantiomere. Damit dies zutrifft, muss die relative Ausrichtung der Hydroxylgruppen in Threose anti sein. Diese Verbindungen können weiter oxidiert werden, um jeweils (–)- und (+)- Weinsäure zu erzeugen.,
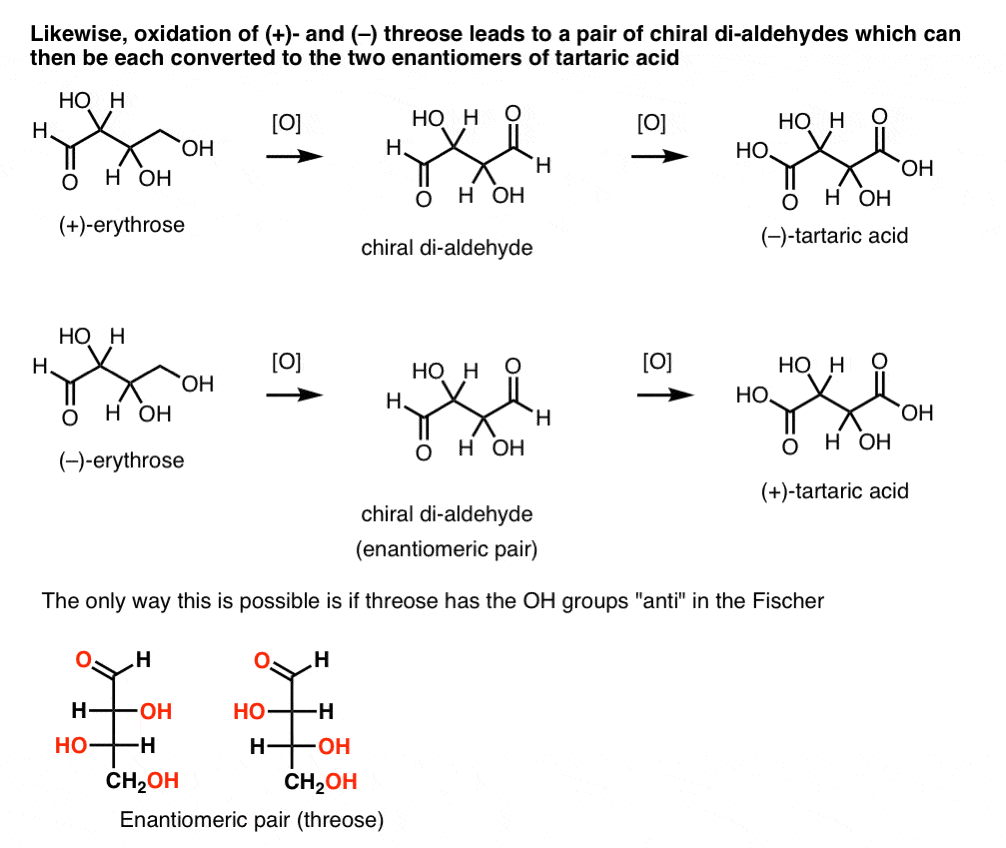
Die gleiche Argumentation kann verwendet werden in die entgegengesetzte Richtung (Minderung). Zum Beispiel kann entweder ( + ) – oder ( – ) – Erythrose auf das Tetra-ol-Erythritol reduziert werden, das Meso ist.
Ebenso führt die Reduktion von ( + ) – und (-) Threose zu einem enantiomeren Paar Tetra-ols, Threitol.
Aus diesen Fakten können wir die relative Ausrichtung der OH-Gruppen ableiten.
(Erweitert), Referenzen und Weitere Reading
- Über die Bezeichnung von optischen Antipoden durch die Buchstaben d und l
Emil Fischer
Ber. 1907, 40 (1), 102-106
DOI: 10.,1002/cber.19070400111
Dies ist das berühmte Papier, wo Prof. Emil Fischer (willkürlich!) zugeordnet (- )- Glyceraldehyd der L-Stereochemie. - Synthesen in der Purin-und Zucker-Gruppe
Emil Fischer
Nobel-Vortrag, 1902,Fischer, Nobel-Vortrag, wo er spricht über seine Arbeit nicht nur an Kohlenhydraten, sondern auch an Purinen, von denen verbindungen wie Koffein und Theobromin sind Mitglieder. Prof. Fisher prognostiziert den Anstieg von Energy Drinks (z.B., Red Bull): „Mit ein wenig Fantasie kann der Tag vorhersehen, an dem Bohnen nicht mehr benötigt werden, um guten Kaffee zuzubereiten: Eine kleine Menge Pulver aus einer Chemikalie, die mit Wasser zusammenarbeitet, sorgt für ein herzhaftes, erfrischendes Getränk überraschend billig“.
- Bestimmung der absoluten Konfiguration optisch aktiver Verbindungen mittels Röntgenstrahlen
BIJVOET, J., PEERDEMAN, A. & van BOMMEL, A.,
Nature 1951, 168, 271-272
DOI: 1038/168271a0
Das berühmte Papier, die bewiesen, dass, mit Hilfe von X-ray structural analysis, die „Emil-Fischer-Konvention, die abgetretenen der Konfiguration von Abb. 2 auf die dextrorotatorische Säure, scheint auf die Realität zu antworten“. - Emil Fischers Entdeckung der Konfiguration von Glukose. A semicentennial retrospect
C. S. Hudson
Journal of Chemical Education 1941, 18 (8), 353
DOI: 10.1021/ed018p353
Eine frühzeitige überprüfung, deckt Prof. Emil Fischers arbeiten in der Kohlenhydrat-Chemie., - Emil Fischers Beweis für die Konfiguration von Zuckern: Eine hundertjährige Hommage
Frieder W. Lichtenthaler
Angew. Chem. Int. Ed. 1992, 31 (12), 1541-1556
DOI: 10.1002/anie.199215413
Ein sehr lesbarer Rückblick von 1992, der Prof. Fischers Arbeit in der Kohlenhydratchemie behandelt und eingehend auf die stereochemischen Zuordnungen von Kohlenhydraten eingeht.
