Other Series
\
los valores para \(n_2\) y wavenumber \(\widetilde{\nu}\) para esta serie serían:
¿sabes en qué región de la radiación electromagnética están estas líneas? Por supuesto, estas líneas están en la región UV, y no son visibles, pero son detectadas por instrumentos; estas líneas forman una serie de Lyman., Las existencias de la serie Lyman y la serie de Balmer sugieren la existencia de más series. Por ejemplo, la serie con \(n_2 = 3\) y \(n_1\) = 4, 5, 6, 7, … se llama serie Pashen.
serie Mulitple
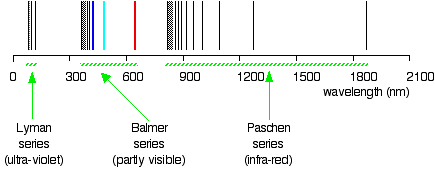
ejemplo \(\PageIndex{1}\): La serie de Lyman
la llamada serie de Lyman de líneas en el espectro de emisión de hidrógeno corresponde a transiciones de varios estados excitados a la órbita n = 1. Calcule la longitud de onda de la línea de menor energía en la serie de Lyman a tres cifras significativas. En qué región del espectro electromagnético ocurre?,
dado: órbita de menor energía en la serie de Lyman
preguntado por: longitud de onda de la línea de Lyman de menor energía y región correspondiente del espectro
estrategia:
solución:
Podemos usar la ecuación de Rydberg (ecuación \ref{1.5.1}) para calcular la longitud de onda:
\
A para la serie de Lyman, \(n_1 = 1\).
Los Espectroscopistas a menudo hablan de energía y frecuencia como equivalentes. La unidad cm-1 (números de onda) es particularmente conveniente. Podemos convertir la respuesta de la Parte A A cm-1.,
y
\
Esta línea de emisión se llama Lyman alfa y es la línea de emisión atómica más fuerte del sol e impulsa la química de la atmósfera superior de todos los planetas produciendo iones mediante la extracción de electrones de átomos y moléculas. Es completamente absorbido por el oxígeno en la estratosfera superior, disociando moléculas de O2 a átomos de O que reaccionan con otras moléculas de O2 para formar ozono estratosférico
B Esta longitud de onda está en la región ultravioleta del espectro.,
ejercicio \(\PageIndex{1}\): La serie Pfund
la serie Pfund de líneas en el espectro de emisión de hidrógeno corresponde a transiciones de estados excitados más altos a la \(n_1 = 5\). Calcular la longitud de onda de la segunda línea en la serie Pfund a tres cifras significativas. ¿En qué región del espectro se encuentra?
respuesta
\(4.65 \ times 10^3\, nm\); infrarrojo
la discusión anterior presenta solo una descripción fenomenológica de las líneas de emisión de hidrógeno y no proporciona una sonda de la naturaleza del átomo en sí., Es evidente que un modelo continuo basado en la mecánica clásica no es aplicable, y como se demuestra en la siguiente sección, se puede formular una conexión simple entre los espectros y la estructura atómica.
