6.3 ¿cómo se relaciona la energía con la longitud de onda de la radiación?
podemos pensar en la radiación como ondas o como partículas individuales llamadas fotones. La energía asociada con un solo fotón está dada por E = hv , donde E es la energía (unidades SI de J), h es la constante de Planck (h = 6.626 x 10-34 J s), y ν es la frecuencia de la radiación (unidades SI de S–1 o Hertz, Hz) (ver figura a continuación)., La frecuencia está relacionada con la longitud de onda por λ = c / ν, donde c, la velocidad de la luz, es 2.998 x 108 m s–1. Otra cantidad que verá a menudo es wavenumber, σ=1/λ, que se informa comúnmente en unidades de cm–1.
La energía de un fotón que tiene la longitud de onda λ es dada por:
E = hc λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., La energía de un mol de fotones que tienen la longitud de onda λ se encuentra multiplicando la ecuación anterior por el número de Avogadro:
E m = hc N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
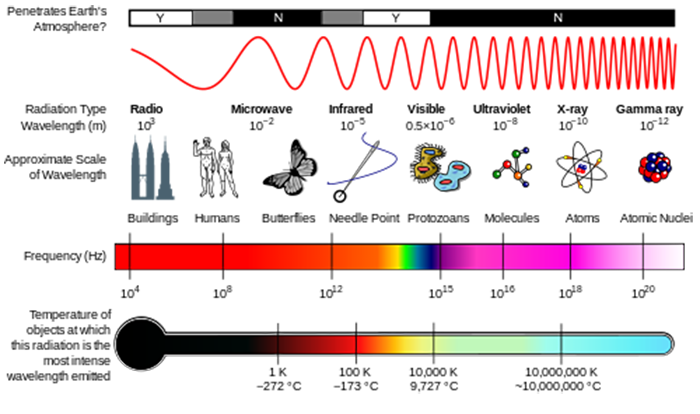
en la lección sobre composición atmosférica, usted vio cómo la radiación solar UV era capaz de romper moléculas para iniciar la química atmosférica. Estas moléculas absorben la energía de un fotón de radiación, y si esa energía fotónica es mayor que la fuerza del enlace químico, la molécula puede romperse.
Compruebe su comprensión
considere la reacción O3 + UV → O2 + o*. Si la fuerza de enlace entre O2 y O* (i. e.,, estado excitado átomo de oxígeno) es 386 kJ mol–1, ¿Cuál es la longitud de onda más larga que un fotón puede tener y todavía romper este enlace?
respuesta: resuelve la longitud de onda en la ecuación
λ = 1.196 × 10 8 J nm mol -1 E m = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
