Introducción
las infecciones nosocomiales causadas por Acinetobacter baumannii multirresistente son cada vez más comunes en todo el mundo, especialmente en el entorno de cuidados intensivos (Wieland et al., 2018). El éxito de esta bacteria se ve facilitado por su capacidad para sobrevivir en una variedad de entornos, agravada por su rápida capacidad para adquirir resistencia a múltiples fármacos. Los carbohidratos de superficie juegan un papel clave en la condición física general y la virulencia de A., baumannii (Lees-Miller et al., 2013; Geisinger e Isberg, 2015; Weber et al., 2016). A. baumannii produce polisacárido capsular (CPS) de alto peso molecular que rodea la membrana externa (Figura 1) (Russo et al., 2010). Compuesto por subunidades de oligosacáridos repetitivos (unidades K), CPS forma una capa discreta en la superficie bacteriana que proporciona protección contra diversas condiciones ambientales, ayudando a evadir las defensas inmunitarias del huésped y aumentando la resistencia a una serie de compuestos antimicrobianos (Russo et al., 2010; Iwashkiw et al., 2012; Geisinger e Isberg, 2015).,
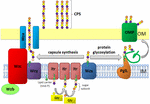
la Figura 1. Representación esquemática del ensamblaje y exportación de polisacáridos de cápsulas en A. baumannii. La síntesis comienza con la transferasa inicial (Itr; granate) ubicada en la membrana interna (IM) transfiriendo el primer azúcar de la unidad repetidora a un portador de lípidos (Und-P; círculo verde). Los azúcares posteriores se añaden a la unidad de crecimiento por glicosiltransferasas específicas (GTR; amarillo) en el lado citosólico de la membrana interna., La subunidad de la cápsula (unidad K) se transfiere al periplasma a través de la proteína de membrana integral Wzx (azul oscuro). Las subunidades de azúcar son polimerizadas por la proteína Wzy (púrpura) y el complejo WZA/Wzb/Wzc (cian, cal, rojo) coordina la polimerización de alto nivel y la exportación de la cadena creciente, moviéndolas a la membrana externa (om). Para la glicosilación, PglL (naranja) une las unidades K a proteínas seleccionadas de la membrana externa (OMP; verde oscuro).
en A. baumannii, el ensamblaje y la exportación de cápsulas se producen a través de una vía dependiente de Wzy (Hu et al.,, 2013; Kenyon y Hall, 2013; Willis y Whitfield, 2013; Woodward y Naismith, 2016) (Figura 1). Típicamente consistente en 4-6 azúcares, la unidad K se ensambla en la molécula portadora de lípidos undecaprenil pirofosfato (Und-P) que proporciona un andamio para la creciente cadena de azúcar (Whitfield, 2006). El primer azúcar en la unidad K es reclutado por una transferasa inicial unida a la membrana interna (IM) (Itr), seguida por la adición secuencial de azúcares a la unidad K en crecimiento por enzimas específicas de glicosil transferasa (GTR) (Figura 1) (Woodward y Naismith, 2016)., Cada unidad K es luego transferida al lado periplásmico del MI por la translocasa Wzx y polimerizada por Wzy, que transfiere la cadena de polisacáridos en crecimiento de un portador Und-P a la siguiente subunidad entrante (Figura 1) (Collins et al., 2007). Después de sintetizar el polímero CPS, es transportado a la superficie celular a través de un proceso altamente coordinado que involucra la interacción de tres proteínas; Wza, Wzb y Wzc, que componen la maquinaria de exportación (Figura 1)., La síntesis de CPS representa un brazo de una vía bifurcada, ya que estas unidades K también se utilizan para decorar ciertas proteínas de superficie a través de la glicosilación de proteínas ligadas a O (Lees-Miller et al., 2013). En este caso, las unidades K individuales son transferidas a las proteínas receptoras por la o-oligosacariltransferasa PglL (Figura 1) (Iwashkiw et al., 2012). En A. baumannii, la glicosilación de proteínas contribuye a la formación de biopelículas al mejorar la fijación inicial y la maduración de las biopelículas, y la patogenicidad como se demostró en varios modelos de infección animal (Iwashkiw et al., 2012; Scott et al., 2014; Harding et al.,, 2015). El Biofilm es un estado de crecimiento en el que las comunidades bacterianas están encerradas dentro de una matriz de exopolisacáridos y se ha demostrado que desempeñan un papel importante en la persistencia y resistencia de A. baumannii.
otros carbohidratos de superficie conocidos por influir en la patogenicidad de A. baumannii incluyen el lipooligosacárido (LOS) y el exopolisacárido poli-β-(1-6)-N-acetilglucosamina (PNAG) (Preston et al., 1996; Weber et al., 2016). PNAG forma el «pegamento» cohesivo de biofilms y constituye una proporción sustancial de biofilms (Choi et al., 2009; Longo et al., 2014)., A diferencia de la mayoría de las bacterias gramnegativas, A. baumannii no produce lipopolisacárido tradicional, sino un Glico-conjugado de superficie similar, LOS, compuesto de un núcleo lipídico A que carece de antígeno O (Kenyon y Hall, 2013; Kenyon et al., 2014b). La pérdida de producción de LOS en A. baumannii disminuye la estabilidad de la membrana externa, lo que lleva a una menor aptitud física (Moffatt et al., 2010; Beceiro et al., 2014).
aunque muchas mitades de carbohidratos influyen en la patogenicidad, se puede argumentar que el SPC es un factor de virulencia predominante de A. baumannii. Esta revisión tiene como objetivo consolidar lo que se conoce sobre A., cápsula de baumannii que incluye estructuras seleccionadas, biosíntesis y organización génica, el papel de las parafinas cloradas en la virulencia y el potencial de las parafinas cloradas como objetivo para el desarrollo futuro de vacunas y fármacos.
organización genética de los Loci k
a medida que los genomas completos de más aislados de A. baumannii están disponibles, la verdadera diversidad de estructuras de cápsulas presentes dentro de esta bacteria se está haciendo evidente. Hasta la fecha, se han identificado más de 100 LOCI cápsula únicos (KL) en A. baumannii (figura 2A) (Shashkov et al., 2017). Estas regiones suelen oscilar entre 20 y 35 kb de tamaño., El análisis de los genes que dirigen la síntesis de CPS en diez genomas completos de A. baumannii resultó originalmente en la designación de nueve tipos de cápsulas, KL1-KL9, que se convirtieron en la base para un esquema de tipificación universal para estos loci (Kenyon y Hall, 2013). Este esquema se ha ampliado posteriormente para dar cabida a la identificación de nuevos loci K. La ubicación cromosómica del locus K, entre los genes fkpa y lldP, está altamente conservada entre las cepas de A. baumannii y contiene aquellos genes necesarios para la biosíntesis y exportación específicos para cada tipo de SPC (Figura 2) (Hu et al.,, 2013; Kenyon y Hall, 2013). Una excepción a esta regla son las cepas de A. baumannii que poseen las regiones KL19 y KL39, donde el gen que codifica la polimerasa Wzy, wzy, se encuentra en una pequeña isla genética en otra parte del cromosoma (Kenyon et al., 2016a). Además, los genes requeridos para algunos de los azúcares comunes vistos en CPS se encuentran en otros lugares., Todos los loci K muestran una configuración genética similar, un grupo altamente variable de genes de síntesis y transferasa requeridos para la biosíntesis de azúcares complejos únicos de tipo KL, flanqueados por un lado por los genes de exportación de CPS altamente conservados, y por el otro lado por un conjunto de genes que codifican azúcares simples y precursores conservados (figura 2a)., Los genes WZX y wzy requeridos para el procesamiento de unidades repetidas son altamente variables entre los loci K (figura 2a, azul claro), lo que indica especificidad para estructuras particulares de unidades K y, en general, el orden de los determinantes de la Trg, que codifican glicosiltransferasas específicas dentro de las regiones KL, corresponde inversamente con el orden de acción.
la región variable de algunos grupos de genes KL, como KL37 y KL14, carecen de genes para la síntesis compleja de azúcares, ya que solo contienen azúcares simples en sus unidades K (Arbatsky et al., 2015; Kenyon et al.,, 2015). Además de su diversidad, varias regiones KL contienen genes redundantes que no son necesarios para la síntesis de la unidad K final. Por ejemplo, KL8 y KL9 contienen dos genes itr (Kenyon y Hall, 2013) y KL37 tiene la fosfogliceroltransferasa pgt1, pero ningún residuo de fosfoglicerol correspondiente en la estructura determinada (Arbatsky et al., 2015). Además, en KL93, dos elementos de secuencia de inserción (ISAba26 e ISAba22) interrumpen el determinante de pgt1 (Figura 2) (Kasimova et al., 2017)., Los genes requeridos para la biosíntesis específica del azúcar no serán discutidos ya que estas vías han sido cubiertas previamente y están más allá del alcance de esta revisión (Hu et al., 2013; Kenyon y Hall, 2013). Además, otros genes ubicados dentro del KL codifican productos predichos para estar involucrados en la acetilación o modificación de la acilación de glicanos específicos (figura 2A, rosa). Aunque el examen de los loci K puede revelar mucho acerca de las estructuras de la unidad K, se requieren análisis químicos y pruebas bioquímicas para determinar estructuras exactas e identificar vínculos específicos entre azúcares repetidos.,
estructuras de parafinas cloradas
los primeros estudios sobre el serotipado de parafinas cloradas de A. baumannii fueron impulsados por la necesidad de desarrollar un método para discriminar aislados de A. baumannii de otras especies de Acinetobacter, ya que el análisis fenotípico estaba cargado de ambigüedad y mala identificación (Traub, 1989). Como se describió anteriormente, hay una diversidad fenomenal vista en los grupos de genes de biosíntesis de A. baumannii CPS, lo que se traduce en la diversidad vista en la estructura de la unidad K (Hu et al., 2013; Kenyon y Hall, 2013). Colectivamente, más de 40 diversos A., las estructuras de la unidad baumannii K se han dilucidado hasta ahora utilizando espectroscopia de RMN y análisis químico. Las estructuras de la unidad K difieren en la composición del azúcar. Pueden incluir derivados de azúcares Unidos a UDP comunes como glucosa, galactosa y ácido glucurónico o azúcares raros y atípicos como ácidos no-2-ulosónicos. Las estructuras varían en longitud y pueden consistir en solo dos residuos, como se ve para parafinas cloradas de tipo K53 (Shashkov et al., 2018), o hasta cinco o seis monosacáridos, como el visto en K37 (figura 2B) (Arbatsky et al., 2015)., Las estructuras también difieren en los enlaces tanto dentro como entre unidades K, lo que resulta en la producción de unidades K que son lineales o involucran ramas laterales, como se ve en K1 y K93, respectivamente (figura 2b) (Kenyon et al., 2016a; Kasimova et al., 2017). Las diferencias en la ubicación de enlaces glucosídicos específicos y los patrones de o-acetilación de varios oligosacáridos dentro de una estructura también contribuyen a la diversidad de la unidad K.,
la variación entre las estructuras de la unidad K puede ser sutil, por ejemplo, K12 y K13 difieren solo por el enlace de dos glicanos, lo que requiere el uso de una polimerasa wzy alternativa; en consecuencia, los loci K de ambas cepas son idénticos excepto para el gen wzy (Figura 2). Alternativamente, la variación puede ser sorprendente, como la incorporación de azúcares raros, incluidos los derivados del ácido pseudamínico, legionamínico o acinetamínico, como se ve en las estructuras K2/6, K49 y K12/13, respectivamente (Figura 2) (Kenyon et al., 2014a, 2015; Vinogradov et al., 2014; Kasimova et al., 2018)., Curiosamente, los derivados del ácido acinetamínico solo se han identificado en A. baumannii y no se encuentran en ningún otro lugar en la naturaleza (Kenyon et al., 2017). Además, algunas unidades K incorporan derivados únicos de glicanos específicos, por ejemplo, el ácido pseudamínico de K93 está acetilado con el grupo A (R)-3-hidroxibutanoil (Kasimova et al., 2017), mientras que en K2 y K6 el ácido pseudamínico es no acetilado (Figura 2)., Además, la estructura de K4 es única, ya que contiene solo aminosugares, D-QuipNAc, y una rama terminal de N-acetil-D-galactosamina (D-GalpNAcA) que está cubierta con un grupo piruvilo, un motivo raro y el PRIMERO en ser descrito en Acinetobacter (figura 2A, negro) (Kenyon et al., 2016b). A medida que aumenta el número de estructuras unitarias K elucidadas, también lo hace la confianza para inferir la estructura unitaria K A partir del análisis de los grupos de biosíntesis posicionados en el KL de A. baumannii., Sin embargo, aunque informativo, una comprensión del papel que desempeña el SPC en la patogénesis es importante para aplicar este conocimiento a la mejora de los resultados de las infecciones por A. baumannii.
papel en la virulencia, resistencia antimicrobiana y persistencia
no hay duda de que la presencia de parafinas cloradas es esencial para la patogenicidad de A. baumannii. No solo es necesario para evadir las defensas inmunitarias del huésped (Russo et al., 2010; Geisinger e Isberg, 2015), pero es importante para la resistencia a los compuestos antimicrobianos y la supervivencia en entornos adversos (Luke et al., 2010; Russo et al.,, 2010; Geisinger e Isberg, 2015). CPS media la evasión inmune en muchas cepas de A. baumannii limitando las interacciones entre las estructuras superficiales inmunogénicas de la bacteria y las defensas del huésped (Preston et al., 1996; Wu et al., 2009; Russo et al., 2010; Umland et al., 2012; Lees-Miller et al., 2013; Geisinger e Isberg, 2015; Wang-Lin et al., 2017). La abolición de la cápsula en múltiples cepas diferentes de A. baumannii ha mostrado una supervivencia reducida en suero humano y líquido de ascitis, y atenuación en modelos de infección de ratas y murinos (Russo et al., 2010; Umland et al., 2012; Lees-Miller et al.,, 2013; Sánchez-Larrayoz et al., 2017). Además, la regulación ascendente de la producción de cápsulas en la cepa A. baumannii comúnmente utilizada ATCC 17978 (tipo K3 CPS) aumentó la resistencia y virulencia séricas en un modelo de infección de ratón (Geisinger e Isberg, 2015). Además, se podrían desarrollar nuevos tratamientos antimicrobianos para tipos específicos de parafinas cloradas, por ejemplo aquellos que contienen ácido pseudamínico, ya que su presencia se ha correlacionado con una mayor virulencia (Hitchen et al., 2010; Kao et al., 2016).
Además de la protección contra las defensas del host, en A., la producción de SPC de baumannii aumenta la resistencia a una serie de compuestos antimicrobianos, incluidos los utilizados para la desinfección en entornos clínicos (Geisinger e Isberg, 2015; Tipton et al., 2015; Chen et al., 2017). Además, el crecimiento de A. baumannii en niveles sub-inhibitorios de antimicrobianos influye en la producción de parafinas cloradas. Por ejemplo, la exposición a los antibióticos cloranfenicol o eritromicina llevó a una mayor síntesis de cápsulas en ATCC 17978 (Geisinger e Isberg, 2015) y la exposición a meropenem seleccionada por mutaciones que conducen a una pérdida en la producción de parafinas cloradas en el aislado 37662 (Chen et al., 2017)., Se requieren estudios realizados en una gama más amplia de cepas de A. baumannii para identificar si la protección contra los antimicrobianos ofrecida por las parafinas cloradas es específica de la cepa, específica del tipo de cápsula o universal.
la capacidad de A. baumannii para persistir en el ambiente clínico ha mejorado indudablemente la colonización y las infecciones en pacientes susceptibles. A. baumannii es capaz de sobrevivir durante meses en superficies hospitalarias como barandillas de cama, muebles y dispositivos médicos, proporcionando un reservorio que a menudo es la fuente de transmisión e infección (Wendt et al., 1997; Gayoso et al., 2013)., La notable tolerancia a la desecación de A. baumannii se cree que se debe a una estrategia de» caída o auge», donde una subpoblación persistente de células sobrevive a expensas de las células moribundas; CPS mejora la tolerancia a la desecación al proporcionar una barrera física que facilita la retención de agua (Roberts, 1996; Webster et al., 2000; Gayoso et al., 2013; Bravo et al., 2016). Recientemente se demostró un papel directo de las parafinas cloradas en la resistencia a la desecación en la cepa A. baumannii AB5075 (tipo K25 parafinas cloradas). En este estudio, la variante acapsular de AB5075 mostró un 2.,5 veces La reducción de la viabilidad en comparación con la cepa parental (Tipton et al., 2018). Además, en dos parientes cercanos de A. baumannii, Acinetobacter calcoaceticus y Acinetobacter baylyi, se ha demostrado que la producción de exopolisacáridos y/o parafinas cloradas promueve la supervivencia a la desecación (Roberson y Firestone, 1992; Ophir y Gutnick, 1994). Además de influir en la resistencia a la desecación, el SPC se ha asociado con otros rasgos de virulencia, incluida la motilidad (McQueary et al., 2012; Huang et al., 2014) y la producción de biofilm (Umland et al., 2012; Lees-Miller et al.,, 2013), consolidando así su papel como factor patógeno.
estudios recientes han relacionado el fenotipo variable de fase de A. baumannii AB5075 con alteraciones en la producción de parafinas cloradas, ya que las variantes opacas altamente virulentas producen una capa de parafinas cloradas con el doble de espesor que sus contrapartes translúcidas (Chin et al., 2018). Esta transición de translúcido a opaco también aumentó dramáticamente el potencial patógeno de A. baumannii AB5075. También aumentó la resistencia a los desinfectantes hospitalarios comunes y a un subconjunto de antibióticos aminoglucósidos (Tipton et al., 2015; Chin et al.,, 2018) y las variantes opacas también fueron más resistentes a la lisozima humana, el péptido antimicrobiano relacionado con la catelicidina LL37 y el peróxido de hidrógeno en comparación con las colonias translúcidas (Chin et al., 2018). Además, los aislados opacos tuvieron una mayor tolerancia a condiciones desecadas y superaron a sus homólogos translúcidos en un modelo de infección de ratón (Chin et al., 2018). Como múltiples factores están involucrados en la variación de fase, se realizaron estudios adicionales para determinar la contribución de la producción de parafinas cloradas al fenotipo opaco más virulento., En una publicación posterior, los autores demostraron que una variante acapsular era significativamente más susceptible a la lisozima y los desinfectantes en comparación con su padre opaco AB5075 de tipo silvestre (Tipton et al., 2018). Curiosamente, no hubo diferencia en la resistencia al LL-37 y al peróxido de hidrógeno entre las cepas opacas de tipo silvestre y acapsular, lo que sugiere que otros factores distintos de la producción de parafinas cloradas conducen a este fenotipo para las variantes opacas de A. baumannii (Tipton et al., 2018).,
la regulación de la producción de parafinas cloradas
las señales ambientales, como la temperatura, la presión osmótica y los cambios en la disponibilidad de metabolitos e iones pueden influir en la producción de parafinas cloradas bacterianas (Hagiwara et al., 2003; Lai et al., 2003; Mouslim et al., 2004; Willenborg et al., 2011). No es sorprendente que se hayan identificado pocos mecanismos regulatorios para la producción de parafinas cloradas, ya que los niveles de parafinas cloradas se regulan comúnmente después de la traducción mediante la fosforilación de la maquinaria de exportación de parafinas cloradas (Whitfield y Paiment, 2003; Chiang et al., 2017). En A., baumannii, solo se han identificado dos reguladores de la producción de cápsulas; Bfmrs y OmpR-EnvZ, ambos dos sistemas de transducción de señales componentes que desempeñan múltiples funciones reguladoras involucradas en la biogénesis de la envolvente (Geisinger e Isberg, 2015; Tipton y Rather, 2017; Geisinger et al., 2018). Cuando se sometió a presión antibiótica, la expresión de A. baumannii ATCC 17978 cps aumentó de manera dependiente de BfmRS (Geisinger e Isberg, 2015). La variación de fase, y por lo tanto potencialmente la producción de CPS, está altamente regulada por el sistema OmpR-EnvZ en A., baumannii AB5075, como mutaciones en OmpR o EnvZ resultaron en un aumento significativo de la frecuencia de conmutación opaca a translúcida (Tipton y Rather, 2017). Aunque la transición de translúcido a opaco resulta en un aumento de dos veces en el grosor de la cápsula, los análisis transcriptómicos no han identificado ninguna diferencia en los niveles de expresión de los genes KL entre las dos fases.
las parafinas cloradas como objetivo para el desarrollo de vacunas y tratamientos contra A. baumannii
a Resistente a antibióticos (específicamente cabapenem)., baumannii está clasificado como un organismo crítico de prioridad 1 de la Organización Mundial de la salud para el desarrollo de nuevos antimicrobianos (OMS, 2017). Aunque no hay tratamientos no antibióticos o vacunas autorizadas Para A. baumannii en la actualidad, hay un mayor interés en su desarrollo y los estudios preliminares parecen prometedores. La exposición superficial y la prevalencia en cepas patógenas de A. baumannii hacen que las parafinas cloradas sean un objetivo ideal tanto para tratamientos antimicrobianos como para vacunas (Russo et al., 2013)., Estos incluyen el desarrollo de terapias basadas en anticuerpos, como vacunas profilácticas, inmunización pasiva y terapia de fagos (García-Quintanilla et al., 2013).
varios estudios han demostrado la eficacia de la inmunización pasiva en ratones utilizando un anticuerpo específico de CPS, que es protector contra la exposición bacteriana con el 13-55% de los aislados clínicos de A. baumannii (Russo et al., 2013; Yang et al., 2017; Lee et al., 2018)., Además, la inoculación con vacunas conjugadas que incorporan CPS glicanos Unidos a un portador de proteína obtener una mejor protección inmunológica que las CPS purificadas contra una amplia gama de cepas de A. baumannii (Yang et al., 2017).
el interés en la terapia de fagos para tratar infecciones bacterianas ha aumentado en los últimos años en respuesta a la crisis actual de aumento de la resistencia antimicrobiana. La terapia de fagos es atractiva como una posible vía de tratamiento para las infecciones por A. baumannii resistentes a múltiples medicamentos., Por ejemplo, se encontró que un fago que codifica una DESPOLIMERASA CPS degrada la CPS de aproximadamente 10%, cuatro de 38, A. baumannii clínico multirresistente (Hernandez-Morales et al., 2018). Aunque el rango de hospedador de este fago es limitado, podría incorporarse como parte de un cóctel de fagos para maximizar la efectividad o atacar brotes específicos (Hernández-Morales et al., 2018). Un fago que corta selectivamente el enlace de A., las parafinas cloradas baumannii en una rama de ácido pseudamínico pueden ser valiosas para la terapia de fagos, o para la fabricación eficiente de parafinas cloradas purificadas para el desarrollo de vacunas y anticuerpos (Lee et al., 2018). Recientemente se demostró que el fago dirigido a A. baumannii es estable cuando se impregna en productos para el cuidado de heridas por quemaduras en una serie de condiciones, incluida la presencia de antimicrobianos (Merabishvili et al., 2017). Sin embargo, como la mayoría de los estudios de investigación de A. baumannii CPS suelen limitarse a una determinada cepa de A. baumannii, no se sabe si estos resultados se traducen a todos los A., aislados de baumannii o si son específicos del tipo de cepa o cápsula. Comprender qué funciones desempeña la cápsula en múltiples cepas es primordial para identificar los tipos de parafinas cloradas que representan los mejores objetivos para las nuevas vacunas, o si el desarrollo de antimicrobianos dirigidos a la vía de biosíntesis de la cápsula es incluso factible.
observaciones finales
aunque la cápsula representa un rasgo de virulencia importante de A. baumannii, hay datos limitados disponibles sobre el papel que desempeñan los diferentes tipos de SPC en la causa de la enfermedad., Para desarrollar vacunas y terapias eficaces dirigidas a las parafinas cloradas, primero debemos obtener una comprensión integral de los mecanismos detrás de su síntesis y expresión, junto con las ventajas que la cápsula transmite a la bacteria huésped. Esta investigación debe abordarse en el contexto de la variación extrema de los serotipos de parafinas cloradas que se encuentran en A. baumannii, para garantizar que las posibles intervenciones funcionen contra las cepas que producen diversas estructuras de parafinas cloradas., Se requieren más estudios sobre las parafinas cloradas para proporcionar una plataforma para el desarrollo de medidas preventivas y tratamientos contra este patógeno humano cada vez más persistente y mortal.
contribuciones del autor
JS escribió el primer borrador. MB proporcionó aportes académicos y una revisión crítica del artículo. FA produjo alineamientos del genoma y proporcionó una revisión crítica del manuscrito. Todos los autores aprobaron la versión final.
financiación
Este trabajo fue apoyado por una subvención de la Fundación de Investigación Médica Flinders a MB. FA fue apoyado por AJ E IM naylon y Playford Trust Ph. D., Beca. JS recibió el apoyo de una beca AJ e IM naylon.
Declaración de conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.
Traub, W. H. (1989). Acinetobacter baumannii serotyping for delineation of outbreaks of nosocomial cross-infection. J. Clin. Microbiol. 27, 2713–2716.
PubMed Abstract | Google Scholar
Whitfield, C., and Paiment, A. (2003)., Biosíntesis y ensamblaje de polisacáridos capsulares del Grupo 1 en Escherichia coli y polisacáridos extracelulares relacionados en otras bacterias. Carbohydr. Res. 338, 2491-2502. doi: 10.1016 / j. carres.2003.08.010
PubMed Abstract / CrossRef Full Text / Google Scholar
WHO (2017). Global Priority List of Antibiotic-Resistant Bacteria to Guide Research, Discovery, and Development of New Antibiotics. Ginebra: Organización Mundial De La Salud.
Google Scholar
