Introducción al grupo carbonilo
en química orgánica, el grupo carbonilo es un grupo funcional donde el carbono y el átomo de oxígeno están conectados con un doble enlace. Los compuestos que contienen el grupo carbonilo se conocen como compuestos carbonilos. El grupo carbonilo se refiere a un monóxido de carbono que también puede unirse a un átomo inorgánico como un ligando que se llama metal carbonilo, por ejemplo, níquel carbonilo.,
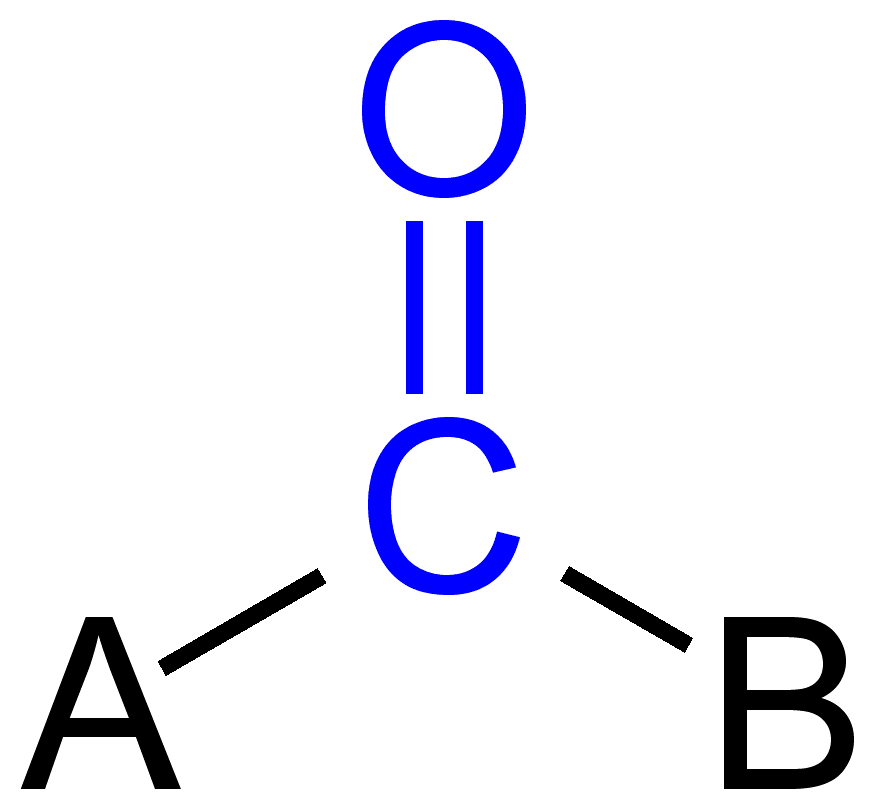
algunos grupos carbonilos
doble enlace en el grupo carbonilo
El átomo de carbono y oxígeno en el grupo carbonilo normalmente se hibridan sp2 y por lo tanto plannar. Debido a la presencia de oxígeno como átomo electronegativo, el doble enlace en el grupo carbonilo es diferente del doble enlace en alquenos en términos de reactividad. Debido a una mayor electronegatividad y la presencia de dos pares de electrones solitarios, el oxígeno se convierte en carga parcialmente negativa, mientras que el carbono carbonilo genera carga parcialmente positiva y, por lo tanto, se observa polaridad.,
estructura de resonancia Carbonílica
debido a la presencia de oxígeno como átomo electronegativo, el grupo carbonilo muestra estructura de resonancia. La estructura de resonancia del grupo carbonilo afecta la reactividad del compuesto. El átomo de oxígeno más electronegativo aleja el electrón del centro de carbono hace que el carbono carbonilo sea parcialmente electropositivo y el oxígeno parcialmente electronegativo. Por lo tanto, la polaridad se genera dentro del compuesto carbonilo.
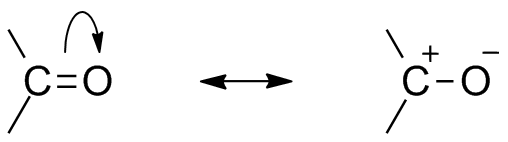
Este electropositivo carbono carbonilo o electrófilo ahora puede ser atacado por un nucleófilo.,
reactividad
Carbonyl Alkylation
la alquilación del grupo carbonilo por reacción de adición nucleofílica utilizando el reactivo de Grignard se muestran de la siguiente manera:

propiedades físicas de los compuestos carbonilos
- El punto de ebullición de los aldehídos y cetonas es mayor que punto de éteres y alcanos de masa molecular similar.
- de nuevo el punto de ebullición de los aldehídos y cetonas son más bajos que los alcoholes correspondientes.,
- Muchos aldehídos superiores tienen un olor agradable y se utilizan en perfumes o como saborizante artificial, mientras que el miembro inferior de su serie homóloga tiene un olor acre.
- Las cetonas más altas tienen un olor suave y las más bajas tienen un olor agradable, como la acetona.
- los aldehídos pequeños y las cetonas son solubles en agua, pero a medida que aumenta la longitud de la cadena, La solubilidad disminuye.
- Las fuerzas de dispersión de Van der Waals se hacen más fuertes a medida que las moléculas se alargan.,
h-bonding en carbonyl goup
debido a la formación de H-bonding entre el oxígeno del carbonilo y el hidrógeno de la molécula de agua, los compuestos más bajos del carbonilo son solubles en agua. Pero a medida que la cadena aumenta, viene en el camino para formar un enlace de hidrógeno y la solubilidad disminuye.
Van der Waals dipolo-dipolo atracción
debido a la polaridad en el grupo carbonilo y la presencia de fuerzas de dispersión habrá una atracción entre dos moléculas cercanas. Esto hace que el punto de ebullición de los compuestos carbonílicos sea más alto que los alcanos correspondientes., En la siguiente tabla, observe que el punto de ebullición de los compuestos carbonílicos es más alto que los alcanos correspondientes y más bajo que los alcoholes.,v>Boiling point (o C)
Spectroscopy
Infrared spectroscopy
The absorption of carbonyl group depends on the geometry of the molecule., Por lo general, la absorción de la luz infrarroja se muestra en números de onda at aproximadamente 1600-1900 cm−1 (5263 nm a 6250 nm).
Resonancia Magnética Nuclear
El carbono-RMN del carbono carbonilo muestra pico aproximadamente entre 160-220 ppm.
