Ejemplo-predicción de polaridad Molecular:
decidir si las moléculas representadas por las siguientes fórmulas son polares ornonpolares. (Es posible que tenga que dibujar estructuras de Lewis y bocetos geométricos a doso.)
un. CO2 b. OF2 c. CCl4 d. CH2Cl2 e. HCN
Solución:
un. La estructura de Lewis para el CO2 es

El electronegativities de carbono y oxygenare 2.55 y el 3,44. El 0.,89 la diferencia en electronegatividad indica que los enlaces EC-O son polares, pero la disposición simétrica de estos enlaces hace que la molécula no sea polar.
si ponemos flechas en el CROQUIS geométrico para el CO2, vemos que se equilibran exactamente entre sí, tanto en dirección como en magnitud. Esto muestra la simetría de los enlaces.
b., La estructura de Lewis para OF2 es
Las electronegatividades de oxígeno y flúor,3.44 y 3.98, respectivamente, producen una diferencia de 0.54 que nos lleva a predecir que los enlaces O-F son polares. La geometría molecular de OF2 está doblada. Suchan distribución asimétrica de enlaces polares produciría una molécula polar.
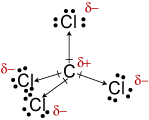
c. La geometría de la molécula de CCl4 istetrahedral., A pesar de que los enlaces C-Cl son polares, su disposición simétrica hace que la molécula no sea polar.


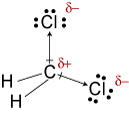
d. TheLewis estructura de CH2Cl2 es
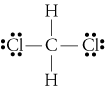
El electronegativities de hidrógeno, carbono, andchlorine son 2.20, 2.55, y 3.16. La diferencia de 0.35 en electronegatividad para los enlaces H-C nos dice que son esencialmente no polares. El 0.,61la diferencia en electronegatividad para los enlaces C-Cl muestra que son polares. Los siguientes bocetos geométricos muestran que los enlaces polares están dispuestos simétricamente, por lo que la molécula es polar. (Observe que la Lewisestructura anterior sugiere incorrectamente que los enlaces están dispuestos simétricamente.Tenga en cuenta que las estructuras de Lewis a menudo dan una falsa impresión de la geometría de las moléculas que representan.)

correo., La nueva estructura y el esquema geométrico para HCN son los mismos:
Las electronegatividades de hidrógeno,carbono y nitrógeno son 2.20, 2.55 y 3.04. La diferencia de 0,35 enelectronegatividad para el enlace H-C muestra que es esencialmente no polar. La 0.49 diferencia en electronegatividad para el enlace C-N nos dice que es polar.Las moléculas con un enlace polar son siempre polares.