trifluoruro de nitrógeno propiedades químicas,Usos, Producción
descripción
el trifluoruro de nitrógeno es un gas incoloro con poco olor. El trifluoruro de nitrógeno es un oxidante que luego es dinámicamente estable excepto a temperaturas elevadas. A temperaturas de hasta aproximadamente 482 ° F (250°C), su reactividad es comparable al oxígeno. A temperaturas más altas, su reactividad es similar al flúor debido a la disociación apreciable en NF2 y F-., La disociación thennal del trifluoruro del nitrógeno ha sido estudiada por un número de investigadores y se ha encontrado a pico en la gama de temperaturas de 1100k a 1500k.en la manipulación del trifluoruro del nitrógeno, las condiciones deben ser evitadas que pueden dar lugar a temperaturas altas tales como compresión adiabática de la presurización rápida de un sistema.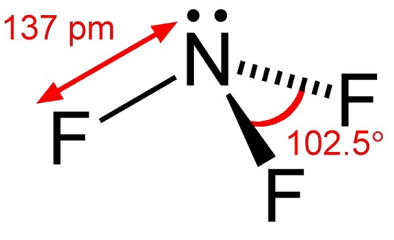
El trifluoruro de nitrógeno actúa principalmente sobre los elementos como agente fluorante, pero no muy activo a temperaturas más bajas., A temperaturas elevadas, el trifluoruro de nitrógeno se piroliza con muchos de los elementos para producir tetrafluoruro de nitrógeno y el fluoruro correspondiente. La pirólisis del trifluoruro de nitrógeno sobre torneados de cobre produce tetrafluoruro de nitrógeno en un rendimiento de 62 a 71 por ciento a 707°F (375°C). La pirólisis sobre el carbono es más completa.
propiedades químicas
el trifluoruro de nitrógeno es un gas incoloro. Moldyodor. Enviado como un gas comprimido no lixiviado.
propiedades físicas
gas incoloro; olor mohoso; licua a -128.75°c; densidad del líquido 3.,116 g/mL; presión de vapor a -158 ° C 96 torr; solidifica a -206.8°C; Temperatura crítica -39.15°C; Presión crítica 44.02 atm; volumen crítico 126 cm3/mol; muy ligeramente soluble en agua.
utiliza
el trifluoruro de nitrógeno es un agente de limpieza de cámara y grabador.oxidante para combustibles de alta energía, síntesis química.
usos
el trifluoruro de nitrógeno es un gas que está hecho de átomos de nitrógeno y flúor., La industria electrónica mundial utiliza trifluoruro de nitrógeno en sus procesos de limpieza, porque el gas supera a otras alternativas, es más fácil y seguro de manejar y ayuda a reducir las emisiones de gases de efecto invernadero.
Los fabricantes de semiconductores, células solares de película delgada y pantallas planas utilizan trifluoruro de nitrógeno para limpiar las cámaras de proceso. Dentro de las cámaras, se aplican capas delgadas de películas semiconductoras y aislantes a obleas y paneles., El trifluoruro de nitrógeno elimina los residuos que estas películas dejan en las paredes de la cámara para que las cámaras puedan funcionar de manera eficiente y producir un dispositivo de calidad.
El trifluoruro de nitrógeno ofrece muchos beneficios sobre los agentes de limpieza alternativos. Es estable a temperatura ambiente, por lo que es relativamente fácil y seguro de manejar. También es fácil usar trifluoruro de nitrógeno para formar un gas energético, o reactivo, o un plasma-un gas con electrones libres. La vida relativamente larga de los radicales de flúor hechos en el plasma hace que el trifluoruro de nitrógeno sea un limpiador eficiente.,
usos
el trifluoruro de nitrógeno se ha utilizado con éxito en grandes cantidades como fuente de flúor para láseres químicos de alta energía. Se prefiere la sobrefluorina debido a su facilidad comparativa de manejo en condiciones ambientales.recientemente, se está utilizando una cantidad cada vez mayor de nitrogentrifluoruro en la industria de los semiconductores como grabador en seco, mostrando tasas de grabado y selectividades significativamente más altas en comparación con el tetrafluoruro de carbono y las mezclas de tetrafluoruro de carbono y oxígeno.,
El trifluoruro de nitrógeno también se utilizó como oxidante en cohetería a principios de la década de 1960, pero esta aplicación no se comercializó.
preparación
el trifluoruro de nitrógeno se prepara por electrólisis de fluoruro de amonio fundido, NH4F, o fluoruro de ácido de amonio fundido, NH4HF2 (o fluoruro de amonio en HF anhidro). Mientras que el método NH4F es preferido porque forma trifluoruro de nitrógeno como el único producto, la electrólisis del fluoruro de ácido amónico produce una pequeña cantidad de difluoruro de dinitrógeno,N2F2 y NF3.,
También, trifluoruro de nitrógeno puede ser preparado por reacción de amoníaco con flúor diluido con nitrógeno en un reactor lleno de cobre. También se producen otros fluoruros de nitrógeno, como N2F2, N2F4 y NHF2. El rendimiento del producto principal depende de la relación flúor/amoníaco y otras condiciones.
Métodos de producción
el trifluoruro de nitrógeno se puede formar a partir de una amplia variedad de reacciones químicas. El proceso comercial para la producción implica la fluoración directa de amoníaco con gas flúor en presencia de fluoruro de amonio.,
reacciones
El hidrógeno reacciona con trifluoruro de nitrógeno con la rápida liberación de grandes cantidades de calor y es la base para el uso de trifluoruro de nitrógeno en láseres químicos de alta energía. El rango de inflamabilidad para las mezclas de trifluoruro de nitrógeno e hidrógeno es de 9.4% a 95% de trifluoruro de nitrógeno. El trifluoruro de nitrógeno reacciona con compuestos orgánicos, pero generalmente se requiere una temperatura elevada para iniciar la reacción., Bajo estas condiciones, la reacción a menudo procederá explosivamente, y se debe tener mucho cuidado al exponer trifluoruro de nitrógeno a compuestos orgánicos. Por lo tanto, el trifluoruro de nitrógeno ha encontrado poco uso como agente fluorante para compuestos orgánicos.
descripción general
un gas incoloro con olor a moho. Muy tóxico por inhalación. Ligeramente soluble en agua. Corrosivo para el tejido. Bajo una exposición prolongada al fuego o al calor, los contenedores pueden romper violentamente y disparar. Se utiliza para fabricar otros productos químicos y como componente de los combustibles para cohetes.,
Air & reacciones de agua
ligeramente solubles en agua.
perfil de reactividad
el trifluoruro de nitrógeno es un agente oxidante muy potente. Presenta peligro de incendio peligroso en presencia de agentes reductores. Graba el vidrio en presencia de humedad. Emite vapores tóxicos y corrosivos de flúor cuando se calienta para descomponerse . Puede reaccionar violentamente con hidrógeno, amoníaco, monóxido de carbono, diborano, sulfuro de hidrógeno, metano, tetrafluorohidrazina, carbón vegetal. Reacción explosiva con dióxido de cloro., Una explosión grave puede ocurrir cuando se expone a agentes reductores bajo presión .
peligro
peligro de explosión grave. Corrosivo para el tejido. Metahemoglobinemia, daño hepático y renal.
peligro para la salud
la inhalación de trifluoruro de nitrógeno puede reducir la capacidad de los glóbulos rojos para transportar oxígeno. Esto causa cianosis, o una decoloración azulada de la piel. Respirar trifluoruro de nitrógeno también puede provocar dolor de cabeza, mareos, debilidad y confusión., Después de una exposición prolongada a altas concentraciones, pueden producirse como efectos secundarios la descomposición de los glóbulos rojos y cambios en el hígado, los riñones, el bazo y el músculo cardíaco. En el aire fresco, los cambios iniciales de glóbulos rojos desaparecerán durante varias horas, pero la persona aún debe ser monitoreada para detectar efectos secundarios.
peligro de Incendio
la sustancia no se quema, pero apoyará la combustión. Algunos pueden reaccionar explosivamente con combustibles. Puede encender materiales combustibles (madera, papel, aceite, ropa, etc.). Los vapores del gas licuado son inicialmente más pesados que el aire y se extienden por el suelo., La escorrentía puede crear riesgo de incendio o explosión. Los contenedores pueden explotar cuando se calientan. Los cilindros rotos pueden dispararse.
usos industriales
el trifluoruro de nitrógeno se ha utilizado con éxito en grandes cantidades como fuente de flúor para láseres químicos de alta energía. Se prefiere sobre el flúor debido a su facilidad comparativa de manejo en condiciones ambientales.,recientemente, una cantidad creciente de trifluoruro de nitrógeno se está utilizando en la industria de semiconductores como un grabador seco, mostrando tasas de grabado y selectividades significativamente más altas en comparación con el tetrafluoruro de carbono y las mezclas de tetrafluoruro de carbono y oxígeno.
El trifluoruro de nitrógeno también se utilizó como oxidante en cohetería a principios de la década de 1960, pero esta aplicación no se comercializó.
los materiales utilizan
a temperaturas inferiores a 482°F (250°C), el trifluoruro de nitrógeno tiene una reactividad similar a la del oxígeno y es relativamente inerte a la mayoría de los materiales de construcción., A temperaturas ambiente, el latón, el aluminio, el cobre, el acero y los aceros inoxidables se pueden usar porque las tasas de corrosión son inferiores a 0.1 mil/año. a 160°F (71.1 ° C) se han determinado para estos materiales. El trifluoruro de nitrógeno es tambiéncompatible con materiales fluorados como la deflón a temperatura ambiente temperatures.At el aumento de las temperaturas y presiones, la reactividad del trifluoruro de nitrógeno aumenta convirtiéndose más como la del flúor, con el níquel y elmonel siendo los materiales preferidos de la construcción.
Perfil de Seguridad
Un veneno. Ligeramente tóxico por inhalación., Absorción prolongada maycause moteado de los dientes, cambios esqueléticos.Riesgo de explosión grave por reacción química con agentes reductores, especialmente cuando se ejerce presión. Un peligro de incendio muy peligroso; un oxidante muy poderoso; otherwiseinert a temperaturas y presiones normales.
exposición potencial
este material se ha utilizado en síntesis química y como oxidante para combustibles de alta energía (como oxidante en combinaciones de propulsores de cohetes).
efectos fisiológicos
ACGIH recomienda un valor límite umbral promedio ponderado por tiempo (TLV-TWA) de 10 ppm (29 mgim3) para el trifluoruro de nitrógeno., TheTLV-TWA es la concentración media ponderada por el tiempo para una jornada laboral no anual de 8 horas y una semana laboral de 40 horas, a la que casi todos los trabajadores pueden estar expuestos repetidamente, día tras día, sin efectos adversos.
OSHA enumera un límite de exposición Pennissible promedio ponderado de 8 horas (TWA-PEL) de 10 ppm (29 mg/m3) para trifluoruro de nitrógeno.TWA-PEL es el límite de exposición que no debe ser excedido por el TWAin de 8 horas en cualquier turno de trabajo de 8 horas de una semana laboral de 40 horas.,la toxicidad del trifluoruro de nitrógeno está relacionada con su capacidad para fonn metahemoglobina, un fonn modificado de hemoglobina incapaz de oxigenotransporte, y para destruir los glóbulos rojos(hemólisis). Al cesar la exposición, la metahemoglobina vuelve espontáneamente a la hemoglobina. Sin embargo, a niveles elevados de exposición,puede ser necesaria una intervención terapéutica (oxígeno, azul de metileno, exanguinotransfusión). La ocurrencia de hemólisis requiere un cuidadoso monitoreo del grado de anemia y el potencial para la función renal dañada.,el valor TLV-TWA del trifluoruro de nitrógeno de 10 ppm resultó de un estudio que expuso ratas a 100 ppm durante 7 horas por día, 5 días por semana durante 18 meses. No se detectaron cambios en el comportamiento de los animales, las tasas cardíacas o pulmonares, los niveles de sangre o la aparición de fluorosis. ACGIH estableció el TLV-TWA en III 0 del nivel de prueba.el trifluoruro de nitrógeno gaseoso se considera inocuo para la piel y un irritante menor para los ojos y las membranas mucosas.
almacenamiento
los cilindros de trifluoruro de nitrógeno deben apoyarse de forma segura mientras estén en uso para evitar el movimiento y el esfuerzo de las conexiones., Los cilindros llenos deben almacenarse en un área bien ventilada, protegidos del calor excesivo (125°F o 51.7°C), ubicados lejos de materiales orgánicos o inflamables, y asegurados. Las tapas de protección de la válvula y las tapas de salida de la válvula deben estar firmemente en su lugar en todo momento cuando el cilindro no esté en uso.
envío
trifluoruro de nitrógeno UN2451, clase de peligro: 2.2;etiquetas: 2.2-gas Comprimido No inflamable; 5.1-oxidante.Los cilindros deben transportarse en una posición vertical segura, en un camión bien ventilado. Proteja el cilindro y las etiquetas del daño físico., El propietario del cilindro de gas comprimido es la única entidad permitida por la Ley federal (49CFR) para transportarlos y rellenarlos. Es una violación de las regulaciones de transporte recargar cilindros de gas comprimido sin el permiso expreso por escrito del propietario.
evaluación de toxicidad
la toxicidad del trifluoruro de nitrógeno está relacionada con su capacidad para fonn metahemoglobina, un fonn modificado de hemoglobina incapaz de transportar oxígeno, y para destruir los glóbulos rojos (hemólisis). Al cesar la exposición, la metahemoglobina vuelve espontáneamente a la hemoglobina., Sin embargo, a niveles elevados de exposición, puede ser necesaria una intervención terapéutica (oxígeno, azul de metileno, exanguinotransfusión). La aparición de hemólisis requiere un cuidadoso monitoreo del grado de anemia y el potencial de deterioro de la función renal.
incompatibilidades
el gas es un potente oxidante. Presenta peligro peligroso de incendio en presencia de agentes reductores. Graba el vidrio en presencia de humedad., Reacciona con aceite, grasa, agentes reductores y otros materiales oxidables;combustibles, orgánicos, amoníaco, monóxido de carbono; metano,hidrógeno, sulfuro de hidrógeno; carbón activado; diborano,agua. Puede reaccionar violentamente con hidrógeno, amoníaco, monóxido de carbono, diborano, sulfuro de hidrógeno, metano,tetrafluorohidrazina, carbón vegetal. El trifluoruro de nitrógeno aumentará la intensidad de un incendio existente.
eliminación de residuos
devuelva los cilindros de gas comprimidos recargables al proveedor., Ventile en un gran volumen de solución de agente reductor concentrado (bisulfitos, sales ferrosas o hipo), luego neutralice y enjuague al alcantarillado con grandes volúmenes de agua.
grados disponibles
el trifluoruro de nitrógeno está disponible en grados que van desde el 98 por ciento hasta el 99.995 por ciento de pureza mínima v/V.
