6.3 Miten energia liittyy aallonpituus säteilyä?
voimme ajatella säteilyä joko aaltoina tai yksittäisinä hiukkasina, joita kutsutaan fotoneiksi. Energia liittyy yksi fotoni saadaan kaavasta E = hv , jossa E on energia (SI-yksikköä J), h on Planckin vakio (h = 6.626 × 10-34 J s), ja ν on taajuus säteilyä (SI-yksiköt s–1 tai Hertsiä, Hz) (ks. kuva alla)., Taajuus on verrannollinen aallonpituuden mukaan λ=c/ν , jossa c, valon nopeus, on 2.998 x 108 m s–1. Toinen usein näkemäsi määrä on aaltomäärä, σ=1/λ, joka ilmoitetaan yleisesti cm–1: n yksikköinä.
yksittäisen fotonin energia, jonka aallonpituus λ on:
e = hc λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., Aallonpituudella λ olevan fotonien moolin energia saadaan kertomalla yllä oleva yhtälö Avogadron numerolla:
e m = hc N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
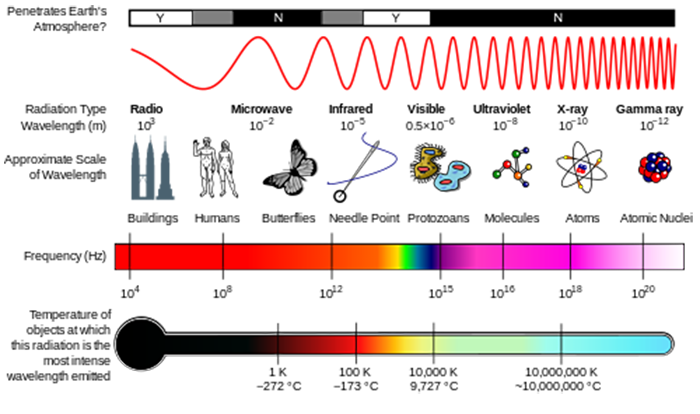
oppitunti ilmakehän koostumus, näit, miten auringon UV-säteily pystyi hajota molekyylejä aloittaa ilmakehän kemia. Nämä molekyylit absorboivat energiaa fotonin säteilyn, ja jos fotonin energia on suurempi kuin vahvuus kemiallinen sidos, molekyyli voi hajota.
Tarkista ymmärryksesi
harkitse reaktiota O3 + UV → O2 + O*. Jos O2: n ja O*: n välinen sidosvahvuus (ts.,, innostunut valtion happea atom) on 386 kJ mol–1, mikä on pisin aallonpituus, että fotoni voi olla ja silti rikkoa tämän siteen?
VASTAUS: Ratkaista aallonpituus yhtälön
λ= 1.196 × 10 8 J nm, mol -1 E m = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
