ESIMERKKI – Ennustaa Molekyylien Polaarisuus:
Päätettäessä molekyylit edustaa seuraavat kaavat ovat polar ornonpolar. (Sinun täytyy ehkä piirtää Lewis rakenteita ja geometrisia luonnoksia doso.)
a. CO2-b. 2. c. CCl4 d. Ch2ci2 e. HCN
Ratkaisu:
a. Lewis rakenne CO2-on
electronegativities hiiltä ja oxygenare 2.55 ja 3.44. 0.,89 elektronegatiivisuus ero osoittaa, että theC-O-sidokset ovat polar, mutta symmetrinen järjestely näiden joukkovelkakirjalainojen makesthe molekyyli-polaarisia.
Jos pistämme nuolia CO2: n geometriseen sketsiin, näemme, että ne täsmälleen tasapainottavat toisiaan sekä suunnassa että magneettisuudessa. Tämä osoittaa sidosten symmetrian.
b., Lewis rakenne 2 on
electronegativities happea ja fluoria,3.44 ja 3.98, vastaavasti, tuottaa 0.54 ero, joka johtaa meidät predictthat, että joukkovelkakirjat ovat polar. OF2: n molekyyligeometria taipuu. Tällainen epäsymmetrinen jakautuminen polar joukkovelkakirjojen tuottaisi polaarinen molekyyli.
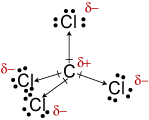
c. Molekyyli geometria CCl4 istetrahedral., Vaikka C-Cl-sidokset ovat polaarisia, niiden symmetrinen järjestäminenmolekyyli ei-polaarisia.
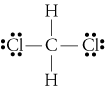
d. TheLewis rakenne Ch2ci2 on
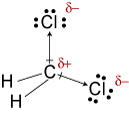
electronegativities vedyn, hiilen, andchlorine ovat 2.20, 2.55, ja 3.16. H-C-sidosten elektronegatiivisuuden 0,35 ero kertoo, että ne ovat olennaisesti ei-polaarisia. 0.,61differenssi elektronegatiivisuudessa C-Cl-sidoksille osoittaa, että ne ovatpolaarisia. Seuraavat geometriset luonnokset osoittavat, että napasidokset ovat epäsymmetrisesti järjestyneitä, joten molekyyli on polaarinen. (Huomaa, että Lewisstructure yllä väärin viittaa siihen, että sidokset ovat symmetrisesti järjestetty.Muista, että Lewisin rakenteet antavat usein väärän kuvan edustamiensa molekyylien geometriasta.)

e., TheLewis rakenne ja geometrinen luonnos HCN ovat samat:
electronegativities vetyä,hiiltä ja typpeä on 2.20, 2.55, ja 3.04. H-C-joukkolainan 0,35: n ero elektronegatiivisuudessa osoittaa, että se on olennaisesti ei-polaarinen. The0.49 ero elektronegatiivisuus C-N-sidos kertoo meille, että se on polar.Molekyylit, joilla on yksi polaarinen sidos, ovat aina polaarisia.