Einführung
Nosokomiale Infektionen durch multiresistente Acinetobacter baumannii werden weltweit immer häufiger, insbesondere auf der Intensivstation (Wieland et al., 2018). Der Erfolg dieses Bakteriums wird durch seine Fähigkeit erleichtert, in einer Vielzahl von Umgebungen zu überleben, die durch seine schnelle Fähigkeit, Multiresistenz zu erlangen, verstärkt werden. Oberflächenkohydrate spielen eine Schlüsselrolle für die allgemeine Fitness und Virulenz von A., baumannii (Lees-Miller et al., 2013; Geisinger und Isberg, 2015; Weber et al., 2016). A. baumannii produziert hochmolekulares Kapselpolysaccharid (CPS), das die äußere Membran umgibt (Abbildung 1) (Russo et al., 2010). CPS besteht aus dicht gepackten sich wiederholenden Oligosaccharid-Untereinheiten (K-Einheiten) und bildet eine diskrete Schicht auf der Bakterienoberfläche, die Schutz vor verschiedenen Umweltbedingungen bietet, bei der Umgehung der Immunabwehr des Wirts hilft und die Resistenz gegen eine Reihe von antimikrobiellen Verbindungen erhöht (Russo et al., 2010; Iwashkiw et al., 2012; Geisinger und Isberg, 2015).,
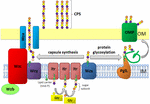
Abbildung 1. Schematische Darstellung der Kapselpolysaccharidanordnung und des Exports in A. baumannii. Die Synthese beginnt mit der anfänglichen Transferase (Itr; Kastanienbraun), die sich in der inneren Membran (IM) befindet und den ersten Zucker der sich wiederholenden Einheit auf einen Lipidträger (Und-P; grüner Kreis) überträgt. Nachfolgende Zucker werden dann der Wachstumseinheit durch spezifische Glykosyltransferasen (Gtr; gelb) auf der zytosolischen Seite der inneren Membran zugesetzt., Die Kapseluntereinheit (K-Einheit) wird dann über das integrale Membranprotein Wzx (dunkelblau) in das Periplasma überführt. Die Zuckeruntereinheiten werden durch das Wzy-Protein (Purpur) polymerisiert und der Wza/Wzb/Wzc-Komplex (Cyan, Kalk, Rot) koordiniert die Polymerisation und den Export der Wachstumskette auf hohem Niveau und bewegt sie zur äußeren Membran (OM). Zur Glykosylierung verknüpft PglL (orange) die K-Einheiten mit ausgewählten äußeren Membranproteinen (OMP; dunkelgrün).
In A. baumannii erfolgt die Kapselmontage und der Export über einen Wzy-abhängigen Weg (Hu et al.,, 2013; Kenyon und Hall, 2013; Willis und Whitfield, 2013; Woodward und Naismith, 2016) (Abbildung 1). Typischerweise bestehend aus 4-6 Zuckern, wird die K-Einheit auf dem Lipidträgermolekül Undecaprenylpyrophosphat (Und-P) zusammengesetzt, das ein Gerüst für die wachsende Zuckerkette bereitstellt (Whitfield, 2006). Der erste Zucker in der K-Einheit wird durch eine innere Membran (IM) – gebundene Initialtransferase (Itr) rekrutiert, gefolgt von der sequentiellen Zugabe von Zuckern zur wachsenden K-Einheit durch spezifische Glykosyltransferase (Gtr) – Enzyme (Abbildung 1) (Woodward und Naismith, 2016)., Jede K-Einheit wird dann von der Wzx-Translocase auf die periplasmatische Seite des IM übertragen und von Wzy polymerisiert, wodurch die wachsende Polysaccharidkette von einem Und-P-Träger auf die nächste eingehende Untereinheit übertragen wird (Abbildung 1) (Collins et al., 2007). Nachdem das CPS-Polymer synthetisiert wurde, wird es über einen stark koordinierten Prozess, der die Wechselwirkung von drei Proteinen beinhaltet, zur Zelloberfläche transportiert; Wza, Wzb und Wzc, die die Exportmaschinen umfassen (Abbildung 1)., Die CPS-Synthese stellt einen Arm eines gegabelten Weges dar, da diese K-Einheiten auch verwendet werden, um bestimmte Oberflächenproteine über O-verknüpfte Proteinglykosylierung zu dekorieren (Lees-Miller et al., 2013). In diesem Fall werden einzelne K-Einheiten durch die O-Oligosaccharyltransferase PglL auf Empfängerproteine übertragen (Abbildung 1) (Iwashkiw et al., 2012). In A. baumannii trägt die Proteinglykosylierung zur Biofilmbildung bei, indem sie die anfängliche Anheftung und Reifung von Biofilmen sowie die Pathogenität verbessert, wie in einer Reihe von tierischen Infektionsmodellen gezeigt (Iwashkiw et al., 2012; Scott et al., 2014; Harding et al.,, 2015). Biofilm ist ein Wachstumszustand, in dem Bakteriengemeinschaften in einer Exopolysaccharidmatrix eingeschlossen sind und nachweislich eine bedeutende Rolle bei der Persistenz und Resistenz von A. baumannii spielen.
Andere Oberflächenkohydrate, von denen bekannt ist, dass sie die Pathogenität von A. baumannii beeinflussen, umfassen Lipoligosaccharid (LOS) und das Exopolysaccharid poly-β-(1-6)-N-Acetylglucosamin (PNAG) (Preston et al., 1996; Weber et al., 2016). PNAG bildet den kohäsiven „Klebstoff“ von Biofilmen und bildet einen wesentlichen Anteil von Biofilmen (Choi et al., 2009; Longo et al., 2014)., Im Gegensatz zu den meisten gramnegativen Bakterien produziert A. baumannii kein traditionelles Lipopolysaccharid, sondern ein ähnliches Oberflächenglyko-Konjugat, LOS, das aus einem Lipid besteht, einem Kern, dem kein O-Antigen fehlt (Kenyon und Hall, 2013; Kenyon et al., 2014b). Der Verlust der Proteinproduktion bei A. baumannii verringert die Stabilität der äußeren Membran, was zu einer verminderten Fitness führt (Moffatt et al., 2010; Beceiro et al., 2014).
Obwohl viele Kohlenhydratmoleküle die Pathogenität beeinflussen, kann argumentiert werden, dass CPS ein vorherrschender Virulenzfaktor von A. baumannii ist. Diese Überprüfung zielt darauf ab, zu konsolidieren, was über A bekannt ist., baumannii, einschließlich ausgewählter Strukturen, Biosynthese und Genorganisation, die Rolle von CPS bei der Virulenz und das Potenzial für CPS als Ziel für zukünftige Impfstoff-und Arzneimittelentwicklung.
Genetische Organisation von K-Loci
Wenn die vollständigen Genome von mehr A. baumannii-Isolaten verfügbar werden, wird die wahre Vielfalt der in diesem Bakterium vorhandenen Kapselstrukturen deutlich. Bis heute wurden über 100 einzigartige Kapselloci (KL) in A. baumannii identifiziert (Abbildung 2A) (Shashkov et al., 2017). Diese Regionen reichen typischerweise von 20 bis 35 kb Größe., Die Analyse der Gene, die die CPS-Synthese in zehn vollständigen A. baumannii-Genomen leiten, führte ursprünglich zur Bezeichnung von neun Kapseltypen, KL1-KL9, die die Grundlage für ein universelles Typisierungsschema für diese Loci bildeten (Kenyon und Hall, 2013). Dieses Schema wurde anschließend erweitert, um der Identifizierung neuer K-Loci Rechnung zu tragen. Die chromosomale Lage des K-Locus zwischen den fkpA-und lldP-Genen ist zwischen A. baumannii-Stämmen stark konserviert und enthält die Gene, die für die Biosynthese und den Export spezifisch für jeden CPS-Typ erforderlich sind (Abbildung 2) (Hu et al.,, 2013; Kenyon und Hall, 2013). Eine Ausnahme von dieser Regel sind A. baumannii-Stämme, die KL19-und KL39-Regionen besitzen, wobei das Gen, das für die Wzy-Polymerase wzy kodiert, auf einer kleinen genetischen Insel an anderer Stelle auf dem Chromosom gefunden wird (Kenyon et al., 2016a). Darüber hinaus werden die Gene, die für einige der üblichen Zucker in CPS erforderlich sind, an anderer Stelle gefunden., Alle K-Loci zeigen eine ähnliche genetische Konfiguration, eine hochvariable Gruppe von Synthese – und Transferase-Genen, die für die Biosynthese einzigartiger KL-Typ-Komplexzucker erforderlich sind, flankiert auf der einen Seite von den hochkonservierten CPS-Exportgenen und auf der anderen Seite von einer Reihe von Genen, die für konservierte einfache Zucker und Vorläufer codieren (Abbildung 2A)., Die für die Repeat-Unit-Verarbeitung erforderlichen wzx-und wzy-Gene sind zwischen K-Loci sehr variabel (Abbildung 2A, hellblau), was auf die Spezifität bestimmter K-Unit-Strukturen hinweist und im Allgemeinen die Reihenfolge der gtr-Determinanten, die für spezifische Glykosyltransferasen innerhalb der KL-Regionen kodieren, umgekehrt mit der Reihenfolge der Aktion entspricht.
In der variablen Region einiger KL-Gencluster wie KL37 und KL14 fehlen Gene für die komplexe Zuckersynthese, da sie nur einfachen Zucker in ihren K-Einheiten enthalten (Arbatsky et al., 2015; Kenyon et al.,, 2015). Zusätzlich zu ihrer Vielfalt enthalten mehrere KL-Regionen redundante Gene, die für die Synthese der endgültigen K-Einheit nicht erforderlich sind. Zum Beispiel enthalten KL8 und KL9 zwei itr-Gene (Kenyon und Hall, 2013) und KL37 weist die pgt1-Phosphoglyceroltransferase auf, jedoch keinen entsprechenden Phosphoglycerolrest in der ermittelten Struktur (Arbatsky et al., 2015). Weiterhin unterbrechen in KL93 zwei Insertionssequenz-Elemente (ISAba26 und ISAba22) die pgt1-Determinante (Abbildung 2) (Kasimova et al., 2017)., Die für die spezifische Zuckerbiosynthese erforderlichen Gene werden nicht diskutiert, da diese Wege zuvor behandelt wurden und über den Rahmen dieser Überprüfung hinausgehen (Hu et al., 2013; Kenyon und Hall, 2013). Darüber hinaus kodieren andere Gene, die sich innerhalb der KL befinden, Produkte, von denen vorhergesagt wird, dass sie an der Acetylierung oder Acylierungsmodifikation spezifischer Glykane beteiligt sind (Abbildung 2A, rosa). Obwohl die Untersuchung der K-Loci viel über K-Einheitenstrukturen aufdecken kann, sind chemische Analysen und biochemische Tests erforderlich, um genaue Strukturen zu bestimmen und spezifische Zusammenhänge zwischen den Zuckern zu identifizieren.,
CPS-Strukturen
Die frühesten Studien zur CPS-Serotypisierung von A. baumannii waren auf die Notwendigkeit zurückzuführen, eine Methode zur Unterscheidung von A. baumannii-Isolaten von anderen Acinetobacter-Arten zu entwickeln, da die phänotypische Analyse mit Mehrdeutigkeit und Fehlidentifikation belastet war (Traub, 1989). Wie oben beschrieben, gibt es eine phänomenale Vielfalt in A. baumannii CPS-Biosynthese-Genclustern, was sich in der Vielfalt der K-Einheitenstruktur niederschlägt (Hu et al., 2013; Kenyon und Hall, 2013). Insgesamt über 40 verschiedene A., baumannii K Einheitenstrukturen wurden bisher mittels NMR-Spektroskopie und chemischer Analyse aufgeklärt. K-Einheitenstrukturen unterscheiden sich in der Zuckerzusammensetzung. Sie können Derivate gängiger UDP-verbundener Zucker wie Glucose, Galactose und Glucuronsäure oder seltene und atypische Zucker wie Nicht-2-Ulosonsäuren umfassen. Strukturen variieren in der Länge und können nur aus zwei Rückständen bestehen, wie für K53 Typ CPS (Shashkov et al., 2018) oder bis zu fünf oder sechs Monosaccharide, wie sie in K37 zu sehen sind (Abbildung 2B) (Arbatsky et al., 2015)., Die Strukturen unterscheiden sich auch in den Verbindungen innerhalb und zwischen K Einheiten, was zur Herstellung von K Einheiten führt, die linear sind oder Seitenzweige beinhalten, wie in K1 bzw. K93 zu sehen ist (Abbildung 2B) (Kenyon et al., 2016a; Kasimova et al., 2017). Unterschiede in der Lage spezifischer glykosidischer Bindungen und O-Acetylierungsmuster verschiedener Oligosaccharide innerhalb einer Struktur tragen ebenfalls zur K-Einheitendiversität bei.,
Die Variation zwischen K-Einheitsstrukturen kann subtil sein, beispielsweise unterscheiden sich K12 und K13 nur durch die Verknüpfung zweier Glykane, was die Verwendung einer alternativen Wzy-Polymerase erfordert; Dementsprechend sind die K-Loci beider Stämme mit Ausnahme des wzy-Gens identisch (Abbildung 2). Alternativ kann die Variation auffällig sein, wie der Einbau von seltenen Zuckern, einschließlich Pseudaminsäure -, Legionaminsäure-oder Acinetaminsäurederivaten, wie sie in K2/6 -, K49-und K12/13-Strukturen zu sehen sind (Abbildung 2) (Kenyon et al., 2014a, 2015; Vinogradov et al., 2014; Kasimova et al., 2018)., Interessanterweise wurden Acinetaminsäurederivate nur in A. baumannii identifiziert und kommen nirgendwo anders in der Natur vor (Kenyon et al., 2017). Zusätzlich enthalten einige K-Einheiten einzigartige Derivate spezifischer Glykane, zum Beispiel wird die Pseudaminsäure von K93 mit einer (R)-3-Hydroxybutanoylgruppe acetyliert (Kasimova et al., 2017), während in K2 und K6 die Pseudaminsäure nicht acetyliert ist (Abbildung 2)., Darüber hinaus ist die Struktur von K4 einzigartig, da sie nur Aminozucker, D-QuipNAc und einen terminalen N-Acetyl-D-Galactosamin (D-GALACTACA) – Zweig enthält, der mit einer Pyruvylgruppe, einem seltenen Motiv und dem ersten, der in Acinetobacter beschrieben wird, bedeckt ist (Abbildung 2A, schwarz) (Kenyon et al., 2016b). Mit zunehmender Anzahl der aufgeklärten K-Einheitenstrukturen steigt auch das Vertrauen, die K-Einheitenstruktur aus der Analyse der in der A. baumannii KL positionierten Biosynthesecluster abzuleiten., Obwohl informativ, ist ein Verständnis der Rolle von CPS bei der Pathogenese wichtig, um dieses Wissen auf die Verbesserung der Ergebnisse von A. baumannii-Infektionen anzuwenden.
Rolle bei Virulenz, antimikrobieller Resistenz und Persistenz
Es steht außer Zweifel, dass das Vorhandensein von CPS für die Pathogenität von A. baumannii unerlässlich ist. Es ist nicht nur notwendig für die Umgehung der Immunabwehr des Wirts (Russo et al., 2010; Geisinger und Isberg, 2015), aber es ist wichtig für die Resistenz gegen antimikrobielle Verbindungen und das Überleben in widrigen Umgebungen (Luke et al., 2010; Russo et al.,, 2010; Geisinger und Isberg, 2015). CPS vermittelt Immunabwehr in vielen A. baumannii-Stämmen durch Begrenzung der Wechselwirkungen zwischen immunogenen Oberflächenstrukturen der Bakterien und Wirtsabwehr (Preston et al., 1996; Wu et al., 2009; Russo et al., 2010; Umland et al., 2012; Lees-Miller et al., 2013; Geisinger und Isberg, 2015; Wang-Lin et al., 2017). Die Abschaffung der Kapsel in mehreren verschiedenen A. baumannii-Stämmen hat ein verringertes Überleben in menschlichem Serum und Aszitenflüssigkeit sowie eine Abschwächung in Ratten-und Murinfektionsmodellen gezeigt (Russo et al., 2010; Umland et al., 2012; Lees-Miller et al.,, 2013; Sanchez-Larrayoz et al., 2017). Darüber hinaus erhöhte die Hochregulierung der Kapselproduktion im häufig verwendeten A. baumannii-Stamm ATCC 17978 (K3 CPS-Typ) die Serumresistenz und Virulenz in einem Mausinfektionsmodell (Geisinger und Isberg, 2015). Darüber hinaus könnten neuartige antimikrobielle Behandlungen für bestimmte CPS-Typen entwickelt werden, beispielsweise solche, die Pseudaminsäure enthalten, da ihre Anwesenheit mit einer erhöhten Virulenz korreliert wurde (Hitchen et al., 2010; Kao et al., 2016).
Neben dem Schutz vor Host-Abwehr, in A., die baumannii CPS-Produktion erhöht die Resistenz gegen eine Reihe von antimikrobiellen Verbindungen, einschließlich solcher, die zur Desinfektion in klinischen Umgebungen verwendet werden (Geisinger und Isberg, 2015; Tipton et al., 2015; Chen et al., 2017). Darüber hinaus beeinflusst das Wachstum von A. baumannii in subhemmenden Konzentrationen von antimikrobiellen Mitteln die CPS-Produktion. Zum Beispiel führte die Exposition gegenüber den Antibiotika Chloramphenicol oder Erythromycin zu einer verstärkten Kapselsynthese bei ATCC 17978 (Geisinger und Isberg, 2015) und Meropenem-Exposition, die für Mutationen ausgewählt wurden, die zu einem Verlust der CPS-Produktion im Isolat 37662 führten (Chen et al., 2017)., Studien, die an einem breiteren Spektrum von A. baumannii-Stämmen durchgeführt wurden, sind erforderlich, um festzustellen, ob der von CPS gewährte Schutz gegen antimikrobielle Mittel stammspezifisch, kapselspezifisch oder universell ist.
Die Fähigkeit von A. baumannii, im klinischen Umfeld zu bestehen, hat zweifellos die Besiedlung und Infektionen bei anfälligen Patienten verbessert. A. baumannii ist in der Lage, auf Krankenhausoberflächen wie Bettschienen, Möbeln und medizinischen Geräten monatelang zu überleben und stellt ein Reservoir bereit, das häufig die Quelle der Übertragung und Infektion ist (Wendt et al., 1997; Gayoso et al., 2013)., Es wird angenommen, dass die bemerkenswerte Austrocknungstoleranz von A. baumannii auf eine „Bust or Boom“ – Strategie zurückzuführen ist, bei der eine anhaltende Subpopulation von Zellen auf Kosten sterbender Zellen überlebt; CPS verbessert die Austrocknungstoleranz durch Bereitstellung einer physischen Barriere, die die Wasserretention erleichtert (Roberts, 1996; Webster et al., 2000; Gayoso et al., 2013; Bravo et al., 2016). Eine direkte Rolle für CPS bei der Austrocknungsresistenz wurde kürzlich im A. baumannii-Stamm AB5075 (Typ K25 CPS) nachgewiesen. In dieser Studie zeigte die akapsuläre Variante von AB5075 eine 2.,5-fache Verringerung der Lebensfähigkeit im Vergleich zur elterlichen Belastung (Tipton et al., 2018). Darüber hinaus hat sich gezeigt, dass bei zwei nahen Verwandten von A. baumannii, Acinetobacter calcoaceticus und Acinetobacter baylyi, die Produktion von Exopolysaccharid und/oder CPS das Austrocknungsüberleben fördert (Roberson und Firestone, 1992; Ophir und Gutnick, 1994). Zusätzlich zur Beeinflussung der Resistenz gegen Austrocknung wurde CPS mit anderen Virulenzmerkmalen in Verbindung gebracht, einschließlich Motilität (McQueary et al., 2012; Huang et al., 2014) und die Produktion von biofilm (Umland et al., 2012; Lees-Miller et al.,, 2013), wodurch seine Rolle als pathogener Faktor zementiert wird.
Neuere Studien haben den phasenvariablen Phänotyp von A. baumannii AB5075 mit Veränderungen in der CPS-Produktion in Verbindung gebracht, da hoch virulente opake Varianten eine CPS-Schicht mit der doppelten Dicke ihrer transluzenten Gegenstücke erzeugen (Chin et al., 2018). Dieser Übergang von transluzent zu undurchsichtig erhöhte auch das pathogene Potenzial von A. baumannii AB5075 dramatisch. Die Resistenz gegen gängige Krankenhausdesinfektionsmittel und eine Teilmenge von Aminoglykosid-Antibiotika war ebenfalls erhöht (Tipton et al., 2015; Chin et al.,, 2018) und opake Varianten waren auch resistenter gegen menschliches Lysozym, das Cathelicidin-verwandte antimikrobielle Peptid LL37 und Wasserstoffperoxid im Vergleich zu transluzenten Kolonien (Chin et al., 2018). Darüber hinaus wiesen opake Isolate eine erhöhte Toleranz gegenüber ausgetrockneten Zuständen und nicht konkurrierenden transluzenten Gegenstücken in einem Mausinfektionsmodell auf (Chin et al., 2018). Da mehrere Faktoren an der Phasenvariation beteiligt sind, wurden weitere Studien durchgeführt, um den Beitrag der CPS-Produktion zum virulenten opaken Phänotyp zu bestimmen., In einer folgenden Veröffentlichung zeigten die Autoren, dass eine akapsuläre Variante im Vergleich zu ihrem undurchsichtigen AB5075 Wildtyp-Elternteil signifikant anfälliger für Lysozym und Desinfektionsmittel war (Tipton et al., 2018). Interessanterweise gab es keinen Unterschied in der Resistenz gegen LL-37 und Wasserstoffperoxid zwischen den opaken Wildtyp-und akapsulären Stämmen, was darauf hindeutet, dass andere Faktoren als die CPS-Produktion zu diesem Phänotyp für opake Varianten von A. baumannii führen (Tipton et al., 2018).,
Regulierung der CPS-Produktion
Umwelthinweise wie Temperatur, osmotischer Druck und Änderungen der Metaboliten-und Ionenverfügbarkeit können die bakterielle CPS-Produktion beeinflussen (Hagiwara et al., 2003; Lai et al., 2003; Mouslim et al., 2004; Willenborg et al., 2011). Es ist nicht überraschend, dass nur wenige regulatorische Mechanismen für die CPS-Produktion identifiziert wurden, da die CPS-Spiegel häufig posttranslational durch die Phosphorylierung von CPS-Exportmaschinen reguliert werden (Whitfield und Paiment, 2003; Chiang et al., 2017). In A., baumannii, bisher wurden nur zwei Regulatoren der Kapselproduktion identifiziert; BfmRS und OmpR-EnvZ, beide Zweikomponenten-Signaltransduktionssysteme, die mehrere regulatorische Rollen in der Hüllkurvenbiogenese spielen (Geisinger und Isberg, 2015; Tipton und Rather, 2017; Geisinger et al., 2018). Bei Antibiotikadruck wurde die A. baumannii ATCC 17978 cps-Expression BfmRS-abhängig erhöht (Geisinger und Isberg, 2015). Phasenvariation, und damit potenziell CPS-Produktion, wird durch das OmpR-EnvZ-System in A stark reguliert., baumannii AB5075 als Mutationen in OmpR oder EnvZ führten zu einem signifikanten Anstieg der undurchsichtigen bis transluzenten Schaltfrequenz (Tipton und Rather, 2017). Obwohl der Übergang von transluzent zu undurchsichtig zu einer zweifachen Zunahme der Kapseldicke führt, haben transkriptomische Analysen keine Unterschiede in den Expressionsniveaus von KL-Genen zwischen den beiden Phasen festgestellt.
CPS als Ziel für die Entwicklung von Impfstoffen und Behandlungen gegen A. baumannii
Antibiotikum (speziell cabapenem) resistent A., baumannii werden als kritischer Organismus der Weltgesundheitsorganisation Priorität 1 für die Entwicklung neuer antimikrobieller Mittel eingestuft (WHO, 2017). Obwohl derzeit keine nicht-antibiotischen Behandlungen oder Impfstoffe für A. baumannii zugelassen sind, besteht ein erhöhtes Interesse an ihrer Entwicklung und Vorstudien sehen vielversprechend aus. Oberflächenexposition und Prävalenz bei pathogenen Stämmen von A. baumannii machen CPS zu einem idealen Ziel sowohl für antimikrobielle Behandlungen als auch für Impfstoffe (Russo et al., 2013)., Dazu gehören die Entwicklung antikörperbasierter Therapien wie prophylaktische Impfstoffe, passive Immunisierung und Phagentherapie (García-Quintanilla et al., 2013).
Mehrere Studien haben die Wirksamkeit der passiven Immunisierung bei Mäusen unter Verwendung eines CPS-spezifischen Antikörpers gezeigt, der mit 13-55% der klinischen A. baumannii-Isolate vor bakterieller Herausforderung schützt (Russo et al., 2013; Yang et al., 2017; Lee et al., 2018)., Darüber hinaus bewirkt die Impfung mit konjugierten Impfstoffen, die CPS-Glykane enthalten, die an einen Proteinträger gebunden sind, einen besseren Immunschutz als gereinigtes CPS gegen eine Vielzahl von A. baumannii-Stämmen (Yang et al., 2017).
Das Interesse an einer Phagen-Therapie zur Behandlung bakterieller Infektionen hat in den letzten Jahren als Reaktion auf die aktuelle Krise steigender antimikrobieller Resistenzen zugenommen. Die Phagen-Therapie ist als möglicher Behandlungsweg für multiresistente A. baumannii-Infektionen attraktiv., Beispielsweise wurde festgestellt, dass ein Phage, der für eine CPS-Depolymerase kodiert, das CPS von ungefähr 10% abbaut, vier von 38, klinisch multiresistente A. baumannii getestet (Hernandez-Morales et al., 2018). Obwohl der Wirtsbereich dieses Phagen begrenzt ist, könnte er als Teil eines Phagen-Cocktails integriert werden, um die Wirksamkeit zu maximieren oder auf spezifische Ausbrüche abzuzielen (Hernandez-Morales et al., 2018). Eine Phage, die selektiv die Verknüpfung von A spaltet., baumannii CPS in einem Pseudaminsäurezweig kann für die Phagentherapie oder zur effizienten Herstellung von gereinigtem CPS für die Impfstoff-und Antikörperentwicklung wertvoll sein (Lee et al., 2018). Es wurde kürzlich gezeigt, dass Phagen, die auf A. baumannii abzielen, stabil sind, wenn sie in Verbrennungswundpflegeprodukten unter einer Reihe von Bedingungen imprägniert werden, einschließlich in Gegenwart von antimikrobiellen Mitteln (Merabishvili et al., 2017). Da jedoch die meisten Studien, die A. baumannii CPS untersuchen, normalerweise auf einen bestimmten A. baumannii Stamm beschränkt sind, ist es nicht bekannt, ob diese Ergebnisse auf alle A übertragen werden., baumannii Isolate oder wenn sie stamm-oder kapselartspezifisch sind. Das Verständnis, welche Rolle Kapsel bei mehreren Stämmen spielt, ist von größter Bedeutung bei der Identifizierung von CPS-Typen, die die besten Ziele für neue Impfstoffe darstellen, oder ob die Entwicklung von antimikrobiellen Mitteln, die auf den Kapselbiosyntheseweg abzielen, tatsächlich sogar machbar ist.
Abschließende Bemerkungen
Obwohl Kapsel ein wichtiges Virulenzmerkmal von A. baumannii darstellt, liegen nur begrenzte Daten über die Rolle vor, die verschiedene CPS-Typen bei der Entstehung von Krankheiten spielen., Um wirksame Impfstoffe und Therapien gegen CPS zu entwickeln, müssen wir zunächst ein umfassendes Verständnis für die Mechanismen gewinnen, die hinter seiner Synthese und Expression stehen, neben den Vorteilen, die Kapsel den Wirtsbakterien vermittelt. Diese Forschung muss im Zusammenhang mit der extremen Variation von CPS-Serotypen in A. baumannii angegangen werden, um sicherzustellen, dass potenzielle Interventionen gegen Stämme wirken, die verschiedene CPS-Strukturen erzeugen., Weitere Studien zu CPS sind erforderlich, um eine Plattform für die Entwicklung präventiver Maßnahmen und Behandlungen gegen diesen zunehmend persistierenden und tödlichen menschlichen Erreger zu bieten.
Autorenbeiträge
JS schrieb den ersten Entwurf. MB lieferte akademischen Input und kritische Überarbeitung des Artikels. FA produzierte Genomausrichtungen und lieferte eine kritische Überarbeitung des Manuskripts. Alle Autoren genehmigten die endgültige Version.
Förderung
Diese Arbeit wurde durch einen Zuschuss der Flinders Medical Research Foundation an MB unterstützt. FA wurde von AJ und IM Naylon und Playford Trust Ph. D unterstützt., Gelehrsamkeiten. JS wurde von einem AJ-und IM Naylon-Stipendium unterstützt.
Interessenkonflikterklärung
Die Autoren erklären, dass die Untersuchung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Traub, W. H. (1989). Acinetobacter baumannii Serotypisierung zur Abgrenzung von Ausbrüchen nosokomialer Kreuzinfektion. J. Clin. Mikrobiol. 27, 2713–2716.
PubMed Abstract | Google Scholar
, Whitfield, C., und Paiment, A. (2003)., Biosynthese und Montage von Kapselpolysacchariden der Gruppe 1 in Escherichia coli und verwandten extrazellulären Polysacchariden in anderen Bakterien. Kohlenhydrate. Res. 338, 2491-2502. doi: 10.1016 / j. carres.2003.08.010
PubMed Abstract / CrossRef Volltext / Google Scholar
WHO (2017). Globale Prioritätenliste von Antibiotika-resistenten Bakterien, um Forschung, Entdeckung und Entwicklung neuer Antibiotika zu leiten. Genf: Weltgesundheitsorganisation.
Google Scholar
