6.3 hogyan kapcsolódik az energia a sugárzás hullámhosszához?
a sugárzást hullámokként vagy egyedi részecskékként, fotonoknak nevezzük. Az egyetlen fotonhoz kapcsolódó energiát E = hv adja, ahol E az energia (J SI egységei), h a Planck állandója (h = 6,626 x 10-34 J s), ν pedig a sugárzás frekvenciája (s–1 vagy Hertz SI egységek, Hz) (lásd az alábbi ábrát)., A frekvencia a λ=c/ν hullámhosszhoz kapcsolódik, ahol a C, a fénysebesség 2,998 x 108 m s–1. Egy másik mennyiség, amelyet gyakran látni fog, hullámszám, σ=1 / λ, amelyet általában cm–1 egységekben jelentenek.
egy λ hullámhosszúságú foton energiáját a következők adják:
E = HC λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., A λ hullámhosszúságú fotonok móljának energiáját úgy találjuk meg, hogy a fenti egyenletet megszorozzuk Avogadro számával:
E m = hc N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
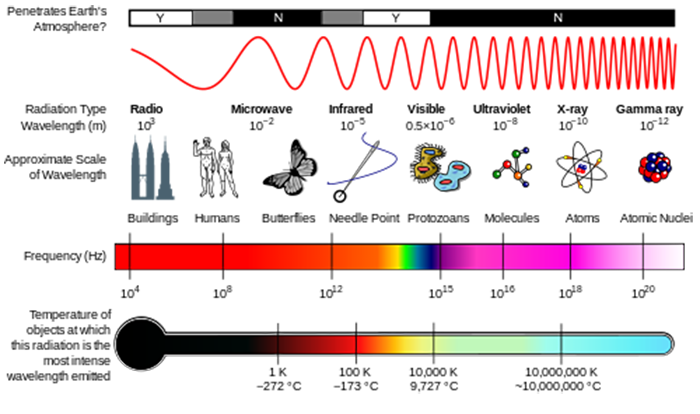
a légköri összetételről szóló leckében látta, hogy a napenergia UV sugárzás képes volt szétválasztani a molekulákat a légköri kémia elindításához. Ezek a molekulák elnyelik a sugárzás fotonjának energiáját, és ha ez a fotonenergia nagyobb, mint a kémiai kötés erőssége, a molekula széteshet.
ellenőrizze megértését
fontolja meg az O3 + UV → O2 + O * reakciót. Ha az O2 és O* közötti kötés szilárdsága (azaz,, gerjesztett állapotú oxigénatom) 386 kJ mol-1, Mi a leghosszabb hullámhossz, amely egy foton lehet, és még mindig megtöri ezt a kötést?
válasz: oldja meg a hullámhossz egyenlet
λ= 1.196 × 10 8 J nm mol -1 E m = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
