amint az az ábrán Látható1, a nukleotidok csak kissé változnak, és csak a nitrogénbázisban. A DNS esetében ezek a bázisok az adenin, a guanin, a citozin és a timin. Vegye figyelembe az adenin és a guanin alakjának hasonlóságát, valamint a citozin és a timin hasonlóságát. Az A és G purinoknak, míg a C és a T pirimidineknek minősülnek. Amíg elnevezzük a dolgokat, vegyük észre a “dezoxiribózt”és a “ribózt”. Ahogy a neve is sugallja, a dezoxiribóz csak egy ribóz oxigén nélkül., Pontosabban, ha van egy hidroxilcsoport, amely a ribóz 2-szénéhez kapcsolódik, akkor csak egy hidrogén kapcsolódik a dezoxiribóz 2-szénéhez. Ez az egyetlen különbség a két cukor között.
in vitro egyetlen nukleinsavszál véletlenszerű felépítésében nincsenek különös szabályok a nukleotidok bázisaikra vonatkozó sorrendjére vonatkozóan. Nitrogénbázisaik azonossága lényegtelen, mivel a nukleotidokat foszfodiészter-kötések kötik össze a foszfátcsoporton és a pentózon keresztül., Ezért gyakran nevezik a cukor-foszfát gerincének. Ha lebontjuk a “foszfodiészter” szót, látjuk, hogy nagyon ügyesen leírja a kapcsolatot: a cukrokat két észterkötéssel ( —O—) kötik össze, amelyek között foszfor van. Az egyik ötlet, amely gyakran összekeveri a diákokat, ennek a kötésnek, ezért általában a nukleinsavak irányossága. Például, amikor a DNS-polimerázról, az enzimről beszélünk, amely katalizálja a nukleotidok hozzáadását az élő sejtekben, azt mondjuk, hogy 5-prím (5′)-3-prím (3′) irányban működik., Ez úgy tűnhet, mint arcane molekuláris-biológus-beszélni, de valójában nagyon egyszerű. Vessen egy pillantást a foszfodiészter kötés által összekapcsolt két nukleotidra (ábra \(\PageIndex{1}\), bal alsó rész). Egy adenin nukleotid csatlakozik egy citozin nukleotidhoz. A foszfodiészter kötés mindig összekapcsolja egy dezoxiribóz (vagy ribóz RNS-ben) 5-szénjét a következő cukor 3-szénével. Ez azt is jelenti, hogy a kapcsolt nukleotidok láncának egyik végén egy szabad 5′ foszfát (-PO4) csoport lesz, a másik végén pedig egy szabad 3′ hidroxil (-OH)., Ezek határozzák meg a DNS vagy az RNS szálának irányosságát.

a DNS általában kettős szálú molekulaként található a sejtben, míg az RNS többnyire egyszálú., Fontos azonban megérteni, hogy a megfelelő körülmények között a DNS-t egyszálúvá lehet tenni, az RNS pedig kettős szálú lehet. Valójában a molekulák annyira hasonlóak, hogy még kettős szálú hibrid molekulákat is lehet létrehozni egy DNS-szálból és egy RNS-ből. Érdekes módon az RNS-RNS kettős hélixek és az RNS-DNS kettős hélixek valójában valamivel stabilabbak, mint a hagyományos DNS-DNS kettős hélix.,
a DNS kettős szálú természetének alapja, sőt a nukleinsavak mint a genetikai információ tárolására és átadására szolgáló közeg alapja bázispárosítás. Az alappárosítás az adeninek és a Timinek, valamint a guaninok és a citozinok közötti hidrogénkötések képződésére utal. Ezek a párok lényegesen stabilabbak, mint a többi lehetséges bázissal kialakult társulás. Továbbá, amikor ezek a bázispár-asszociációk két nukleinsav-szál összefüggésében alakulnak ki, a távolságuk is egyenletes és nagyon stabil., Emlékeztethet arra, hogy a hidrogénkötések viszonylag gyenge kötések. A DNS összefüggésében azonban a hidrogénkötés teszi a DNS-t rendkívül stabilvá, ezért alkalmas hosszú távú tárolóeszközként a genetikai információkhoz. Mivel még az egyszerű prokariótákban is a DNS kettős spirálok legalább ezer nukleotid hosszúak, ez azt jelenti, hogy több ezer hidrogénkötés tartja össze a két szálat., Bár minden egyes nukleotid-nukleotid hidrogén kötés kölcsönhatás könnyen átmenetileg megzavarta egy enyhe hőmérséklet-emelkedés, vagy egy apró változás az ionos szilárdsága az oldat, egy teljes kettős spirál DNS igényel nagyon magas hőmérsékleten (általában több mint 90oC), hogy teljesen denaturálja a kettős spirál egyes szálak.
mivel a nukleotidok pontos egy-egy párosítása van, kiderül, hogy a két szál lényegében egymás biztonsági másolata – biztonsági háló abban az esetben, ha a nukleotidok elvesznek egy szálból., Valójában, még akkor is, ha mindkét szál részei megsérülnek, mindaddig, amíg a másik szál sértetlen a károsodás területén, akkor az alapvető információk még mindig ott vannak az ellenkező szál kiegészítő sorrendjében, és a helyére írhatók. Ne feledje azonban, hogy míg az egyik DNS – szál így a másik “biztonsági másolataként” működhet, a két szál nem azonos-kiegészítik egymást. A komplementer és antiparallel szálak rendszerének érdekes következménye, hogy a két szál mindegyike egyedi információkat hordozhat.,
a kétirányú génpárok két gén a DNS ellentétes szálain, de egy promoter megosztása, amely közöttük van. Mivel a DNS csak egy irányban, 5′ 3′, ez a bi-directional szervező, gyakran a CpG szigeten (lásd következő fejezet), ezért elküldi az RNS polimeráz minden egyes gén ellentétes fizikai irányokat. Ezt kimutatták a rákokban (mell, petefészek) részt vevő számos gén esetében, és ez egy mechanizmus a géntermékek hálózatainak kifejeződésének összehangolására.
a DNS kettős spirál szálai antiparallel., Ez azt jelenti, hogy ha egy DNS kettős spirálját nézzük balról jobbra, akkor az egyik szál 5-3 irányban lenne felépítve, míg a kiegészítő szál 3-5 irányban van kialakítva. Ez fontos az enzimek működéséhez, amelyek DNS-t hoznak létre és javítanak, amint azt hamarosan megvitatjuk. A \(\PageIndex{1}\) ábrán a bal oldali szál 5′ – 3′ felülről lefelé, a másik pedig 5′ – 3 ‘ alulról felfelé.
fizikai szempontból a DNS-molekulák negatív töltésűek (az összes foszfát), általában kettős spirál, jobbkezes csavarral., Ebben a normál (más néven “B” konformáció) állapotban a molekula egy teljes csavarása 11 bázispárt foglal magában, 0,34 nm-rel az egyes nukleotidbázisok között. A nitrogénbázisok mindegyike sík, a komplementer bázissal párosítva a DNS “létráján” a planáris “rung” – ot képez. Ezek merőlegesek a DNS hossztengelyére. Ebben a B konformációban található meg a sejtben szabadon lebegő DNS nagy része, és a legtöbb DNS a fiziológiás ozmolaritás és pH bármely vizes oldatában., Más konformációkat azonban találtak, általában nagyon különleges környezeti körülmények között. Az in vitro kristályosodás tárgyaként egy tömörített konformációt, A-DNS-t figyeltek meg, amelynek fordulónként valamivel több bázisa, rövidebb fordulási hossza és a hossztengelyre nem merőleges bázispárjai vannak. Egy másik, Z-DNS, úgy tűnik, hogy átmenetileg kialakul a GC-ben gazdag DNS-szakaszokban,amelyekben érdekes módon a DNS az ellenkező irányba fordul.
azt javasolták, hogy mind az A, mind a Z DNS-formák valójában fiziológiailag relevánsak., Bizonyíték van arra, hogy az a forma előfordulhat RNS-DNS hibrid kettős hélixekben, valamint amikor a DNS egyes enzimekhez komplexálódik. A Z konformáció a DNS metilációjára adott válaszként fordulhat elő. Ezenkívül a “normál” B-DNS konformáció egy idealizált struktúra, amely a teljes hidratáláson alapul, mint minden bizonnyal nagyon valószínű egy sejten belül. Ez a hidratációs állapot azonban folyamatosan változik, bár aprólékosan, így a DNS-konformáció gyakran kissé eltér a \(\PageIndex{2}\) ábrán látható B-konformációs paraméterektől.,
a prokariótákban a DNS megtalálható a citoplazmában (meglehetősen nyilvánvaló, mivel ezekben az egyszerű szervezetekben nincs más választás), míg az eukariótákban a DNS a mag belsejében található. A helyük különbségei ellenére a külső erőkkel szembeni védelem szintje, mindenekelőtt méretük, mind a prokarióta, mind az eukarióta DNS olyan fehérjékkel van csomagolva, amelyek segítenek a teljes kromoszóma szerkezetének megszervezésében és stabilizálásában., A prokarióta kromoszómacsomag tekintetében viszonylag keveset értünk, bár strukturális hasonlóságok vannak a prokarióta és eukarióta kromoszómákban található egyes fehérjék között. Ezért a legtöbb bevezető sejtbiológiai tanfolyam ragaszkodik az eukarióta kromoszóma csomagoláshoz.

a meztelen DNS, akár prokarióta, akár eukarióta, rendkívül vékony anyagszál, körülbelül 11 nm átmérőjű. Azonban, tekintettel az eukarióta genomok méretére, ha a DNS-t így tárolták a mag belsejében, akkor kezelhetetlenül kusza lesz. Képzelj el egy vödröt, amelybe száz méter fonalat dobott anélkül, hogy bármilyen kísérletet tett volna arra, hogy megszervezze azt tekercseléssel vagy csomózással., Most fontolja meg, hogy képes lenne-e elérni azt a vödröt, amely egy szálat húz, és elvárja, hogy csak egy szálat húzzon fel, vagy ha inkább legalább egy kis fonalat húz fel. A cella lényegében azt teszi, amit a fonallal tenne, hogy szervezett maradjon: szépen csomagolva kisebb, kezelhető gombolyagokba. A DNS esetében minden kromoszómát egy hiszton komplex köré hurkolnak, hogy a kromoszómális szervezet első rendjét képezzék: a nukleoszómát.
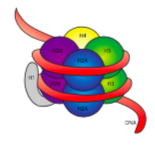
a 30 nm-es rostot két kölcsönhatási készlet tartja össze. Először is, a linker histone, H1, a nukleoszómákat közelítő 30 nm-es szerkezetbe hozza., Ezt a szerkezetet ezután diszulfidkötésekkel stabilizálják, amelyek egy nukleoszóma H2A hisztonja és a szomszéd H4 hisztonja között alakulnak ki.
a hisztonok az alapvető (pozitív töltésű) fehérjék családja. Mindannyian elsősorban a DNS szervezésében működnek, és a nukleoszóma akkor alakul ki, amikor a DNS (kicsit több mint 2 – szer) nyolc hiszton magja körül forog-mindegyik H2A, H2B, H3 és H4. A pozitív töltések száma és helyzete (főleg a lizinekből és az argininekből) döntő fontosságú ahhoz, hogy képesek legyenek szorosan kötődni a DNS-hez, ami, mint korábban említettük, nagyon negatív töltésű., Az, hogy az “ellentétek vonzzák” ötlet nem csak egy társkereső tipp a tanácsadási oszlopokból.

a vizsgálat során a 3D szerkezet a histone core komplex, azt látjuk, hogy míg a viszonylag töltetlen fehérje kölcsönhatás tartományok tartsa a histones együtt a központban, a pozitív töltésű maradványok találhatók körül a külső komplex, elérhető, hogy kölcsönhatásba lépnek a negatív töltésű foszfátok a DNS-t.,
egy későbbi fejezetben arról fogunk beszélni, hogy az enzimek hogyan olvassák a DNS-t, hogy információit kisebb, kezelhetőbb RNS-darabokra írják át. Egyelőre csak tisztában kell lennünk azzal,hogy egy adott időpontban a DNS nagy része szorosan el van csomagolva, míg a DNS egyes részei nem. Mivel a felhasználásra rendelkezésre álló részek attól függően változhatnak, hogy mi történik a sejtben/a sejtben bármikor, a DNS csomagolásának dinamikusnak kell lennie. Léteznie kell egy mechanizmusnak, amely gyorsan lazítja a DNS hisztonokhoz való kötődését, amikor a DNS-nek szüksége van a gén expressziójára, és akkor húzza meg a kötést, ha nem., Mint kiderült, ez a folyamat magában foglalja a hisztonok acetilezését és deacetilezését.

a hiszton Acetiltranszferázok (kalapok) olyan enzimek, amelyek acetilcsoportot helyeznek egy hiszton fehérje lizinjére. Az acetilcsoportok negatív töltésűek, az acetiláció nemcsak negatív töltésű csoportot ad hozzá, hanem eltávolítja a pozitív töltést a lizinből is. Ennek az a hatása, hogy nem csak semlegesíti a fehérje és a DNS közötti vonzási pontot, hanem enyhén taszítja is (hasonló töltésekkel)., A mechanizmus másik oldalán a hiszton-Deaktilázok (Hdac-ok) olyan enzimek, amelyek eltávolítják az acetilációt, és ezáltal helyreállítják a hisztonfehérje és a DNS közötti kölcsönhatást. Mivel ezek olyan fontos enzimek, magától értetődik, hogy nem szabad szándékosan működtetni bármely rendelkezésre álló hisztonon, és valójában gyakran olyan komplexben találhatók, amely más fehérjékkel szabályozza és koordinálja aktiválásukat más folyamatokkal, például a transzkripció aktiválásával.
