A D – és L-jelölés a cukrok és aminosavak abszolút konfigurációjára
mi különbözteti meg a “D-glükózt” az ” L-glükóztól ? Vagy D-alanin az L-alaninból?
és egyébként mi ez a D – és L – nómenklatúra? Olvass tovább:
Tartalomjegyzék
- D – and L – gyors rövidítést biztosít az enantiomerek
- kijelöléséhez miért foglalkozunk ezzel az ősi nómenklatúrával?,
- az “abszolút konfiguráció”
- négy szén – aldehid D – és L-cukrok (Aldotetrózok)
- öt szén – aldehid D – és L-cukrok (Aldopentózisok)
- hat szén – aldehid D – és L-cukrok (Aldohexózisok)
- de várj – van még! (Aminosavak)
- összefoglaló: D – és L-jelölés cukrokra és aminosavakra
- Megjegyzések
- (haladó) referenciák és további olvasás
D-és L-gyors gyors Gyorsírást biztosít az enantiomerek
D – és L-jelölés megjelöléséhez.,
D-a glükóz például az L-glükóz enantiomerje. Mivel az L-alanin a D-alanin enantiomerje.
az alábbiak szerint van hozzárendelve. A cukor húzott a Fischer-projekció a legtöbb oxidált szén tetején (azaz aldehid vagy keton)
- ha az OH az alsó királis központ jobbra mutat, ez a továbbiakban a D-
- ha az OH az alsó királis központ pontot a bal oldalon, úgy nevezik, mint L- .
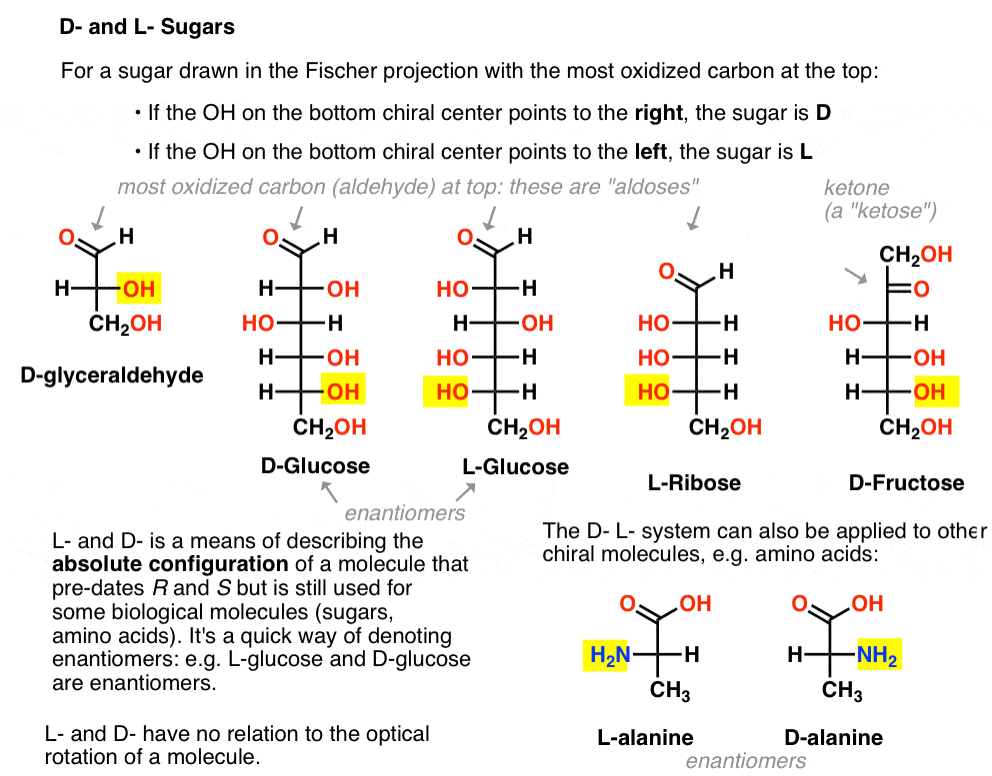
Ez a terminológia aminosavakra is alkalmazható: lásd L – és D – alanin a fenti képen.,
2. Miért Foglalkozunk Ezzel Az Ősi Nómenklatúrával?
indokoltan megkérdezheti: nincs-e már rendszerünk az abszolút konfiguráció hozzárendelésére ? Miért van szükségünk egy új rendszerre?
A D-L rendszer nem új rendszer, Emberek. Ez a régi rendszer-megelőzi Cahn-Ingold-Prelog.
A D-L rendszer szó szerint a ló-buggy korszak maradványa, amely az 1800-as évek végén Emil Fischer szénhidrátokkal kapcsolatos munkájához nyúlik vissza – amikor a szerves kémikusoknak nem volt módjuk meghatározni a sztereokenterek abszolút konfigurációját, amely csak 1951-ben vált lehetővé (thx, Bijvoet).,
akkor miért használják még mindig? Nem kellene a történelem szemetesébe rakni, csúszásszabályokkal, 8 sávos kazettákkal és 5 ¼ ” – os floppy lemezekkel együtt?
nos, vannak virágzó közösségek Amerika vidéki részein, ahol a lovas kocsik továbbra is fennállnak-ha tudod, hol kell keresni. (Talán egyszer majd lesznek olyan települések, ahol az emberek csak az 1970-es és 1980-as évek számítógépes technológiáját használják?)
hasonlóképpen van egy szerves kémiai zseb is, ahol a D – L rendszer még mindig használatot talál, és ez kifejezetten a cukrok és aminosavak birodalmában van.,
Ez egyébként nem Amish kémikusok lázadása A CIP rendszer modern gonoszságai ellen. A cukrok és aminosavak esetében legalább 3 jó ok van arra, hogy L – és D -:
- rövidséget használjunk. D-glükóz egy pokoli sokkal gyorsabb írni és mondani, mint (2R, 3S,4R, 5R)2,3,4,5,6-pentahydroxyhexanal. Az L- / D-rendszer lehetővé teszi a több királis központú molekula konfigurációját egyetlen betűvel (plusz a közös neve, természetesen – Noel köszönhetően az emlékeztetőnek)
- több rövidség., Előfordul, hogy gyors módja az enantiomerekre való hivatkozásnak. Az L-glükóz enantiomerje D-glükóz. Az L-triptofán enantiomerje a D-triptofán. És bár a ( + ) – vagy ( – ) – előtagokat használhatnánk a glükóz és más cukrok két enantiomerjének megkülönböztetésére, az optikai elfordulás jele változhat oldószerrel, hőmérséklettel, koncentrációval és más tényezőkkel, ami az ideálisnál kevésbé teszi lehetővé. Plusz, L – és D-kifejezetten az abszolút konfigurációra utal, míg (mint korábban említettük) nincs egyszerű kapcsolat az optikai elfordulás jele és a konfiguráció között.,
- kiderül, hogy a legtöbb természetben előforduló cukor D-, A legtöbb természetben előforduló aminosav pedig L- . Ebben az állításban óriási mennyiségű információ tömörül, és nincs olyan versengő rendszer (R/S,+/–), amely az L – t és a D – t egyetlen karakterrel helyettesíthetné. Megjegyzés
ismétlődik: cukrokkal és aminosavakkal az L – és D – hasznos megnevezések lehetnek. Más molekulák esetében nagyrészt elfelejtheti.
tehát mi ez a D- / L-rendszer, és hogyan kapcsolódnak ezek a kifejezések a struktúrához?,
gyere velem utazunk vissza az időben.
A L – D – Rendszer Hozzárendelése “Abszolút Konfiguráció”
Emil Fischer kezdett el tanulni szénhidrátok a késő 1880-as években. Volt ismert, hogy az idő (via Van, nem Hoff), hogy a szén volt, jó volt az is ismert, hogy a molekulák, amelyek a szén-négy különböző substituents lehet forgatni síkban polarizált fény (pl. Pasteur). Ami nem volt ismert, az a királis molekulák abszolút konfigurációja volt-amit ma “R” és “S” konfigurációjuknak neveznénk.,
a királis központot tartalmazó legegyszerűbb szénhidrát a gliceraldehid, C3H6O3. A gliceraldehidnek három karbonja van; így “trióz”. A gliceraldehidben a leginkább oxidált szén egy aldehid,ami szintén “aldóz”.
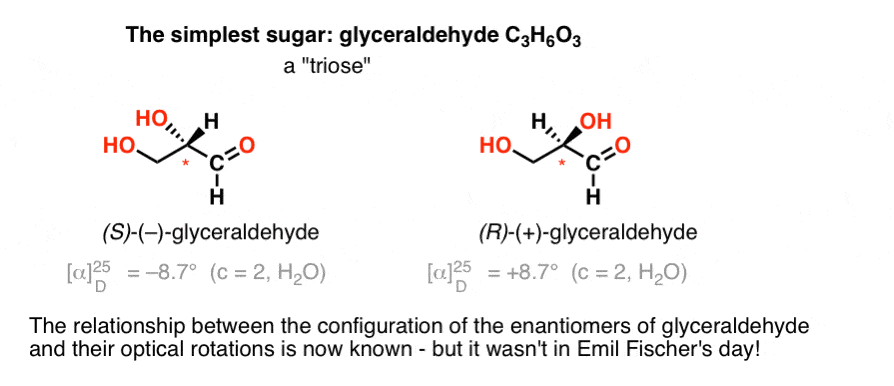
1888-ban a gliceraldehid két enantiomerjét izolálták és jellemezték., Mivel azonban nincs egyszerű összefüggés a királis Centrum konfigurációja és a sík polarizált fény forgásának iránya között, Emil Fischer nem tudta a ( + )-és ( – ) –gliceraldehid optikai forgását a királis Centrum körüli atomok abszolút konfigurációjához kötni.
a mai terminológiát használva nem tudta, hogy ( – ) – gliceraldehid (R) vagy (S).
hiányzik ez a kulcsfontosságú információ, Fischer úgy döntött, hogy kitalálja.,
a találgatás, ami helyesnek bizonyult, az volt, hogy ( – ) – a gliceraldehidnek megvan az a konfigurációja, amit most S-nek hívunk, és hogy (+) – a gliceraldehidnek az a konfigurációja, amit most R.
– nek hívunk, természetesen Cahn, Ingold és Prelog még nem született meg, és a CIP rendszert csak Bijvoet 1951-es munkája után fejlesztenék ki. Így Fischer kifejlesztette saját nómenklatúráját.
a később Fischer-vetületnek nevezett gliceraldehidet rajzolva a bal oldali konfigurációt ( – ) – gliceraldehidre osztotta, és L – nek (a Latin laevo rövidítése) nevezte., Ezután a jobb oldali konfigurációt (+)-gliceraldehidhez rendelte, és D – nek (Latin dextro) nevezte.
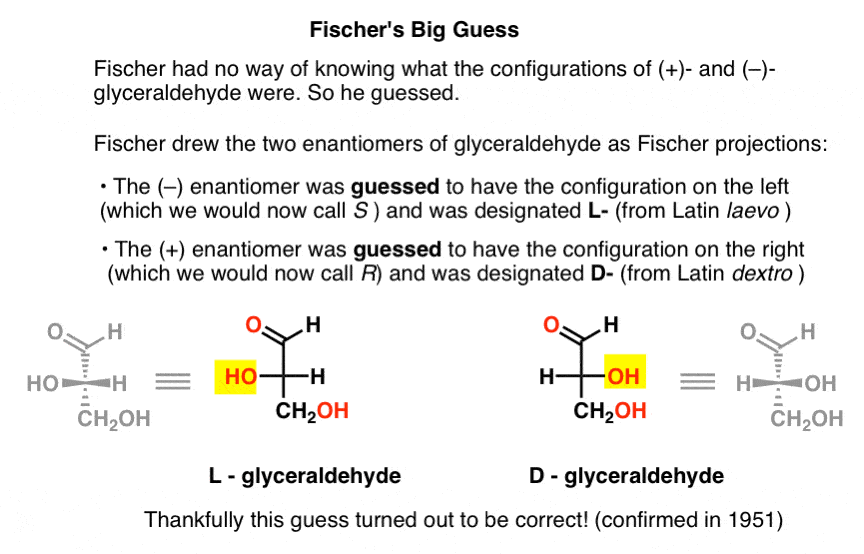
miért olyan fontos ez?
az L – és D – gliceraldehid abszolút konfigurációjának hozzárendelése kicsit olyan volt, mint az elsődleges meridián (0° hosszúság) hozzárendelése az angliai greenwichi királyi Obszervatóriumhoz., Csakúgy, mint a föld minden más helyének hosszúsági foka, ezt a pontot is meg lehet határozni, ha relatív távolságuk ismert, akkor minden más sztereocentrum abszolút konfigurációját meg lehet határozni, ha az L – vagy D – gliceraldehidhez viszonyított konfigurációja ismert.
lehet, hogy nem ez a legtisztább analógia. Tehát nézzük meg a 4-széntartalmú cukrokat egy másik példában.,
négy szén-aldehid D – és L-cukor (Aldotetrózok)
Miután az L – és D – gliceraldehid abszolút konfigurációját javasolták, a többi királis vegyület abszolút konfigurációját analógia útján lehetett megállapítani (és sok kémiai grunt munka).
Ez nem döntő fontosságú a mai, de egy példa az ilyen érvelés, lásd ezt .
vissza, amikor a királis központok fogalmát bevezették, valószínűleg megtudta, hogy egy n királis központú molekulának 2N sztereoizomerje lesz (mindaddig, amíg nincsenek mezo-vegyületek).,
két négyszén aldózis, háromszén és erythrose található. Mindegyiknek két királis központja van. Mindegyik enantiomer (L – és D -) párként létezik, összesen négy sztereoizomert adva.
itt vannak. Az alábbi ábrán fontos megjegyezni, hogy az L-cukrcsalád bal oldalán az alsó királis szén OH csoportja van, a D-családban pedig az alsó királis szén OH csoportja van a jobb oldalon (kiemelve).,
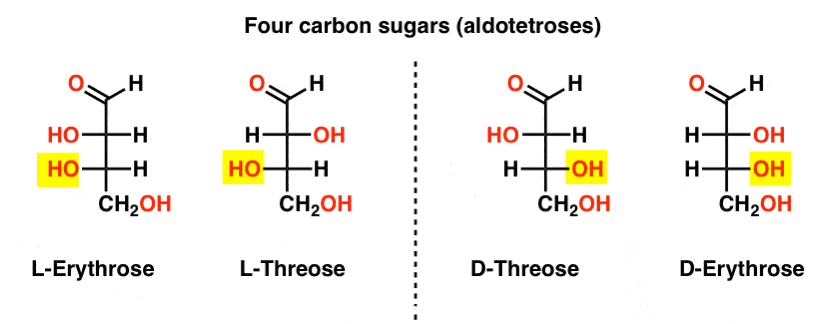
nézze meg, hogyan épül fel az L-Erythrose és az L-Threose az L-gliceraldehidben (kiemelve) létrehozott sztereocenterre, valamint d-Erythrose és D-Threose a D-gliceraldehidben (kiemelve) létrehozott sztereocenterre (kiemelve).
cukrok épül fel egy kicsit, mint a bináris rendszer; lehet gondolni minden stereocenter egy “kicsit”, hogy lehet egy két érték. Az L-erythrose és az L-threose konfigurációja csak egy sztereocentrumban különbözik. Ha megfordítanánk a H és OH helyzetét, megkapnánk a másikat., Ennek a kapcsolatnak van egy neve, amelyet néha láthat: két olyan molekulát, amelyek csak egy sztereocentrumban ellentétes konfigurációval rendelkeznek, epimereknek nevezzük, különösen akkor, ha a sztereocentrumhoz csatolt atomok egyike hidrogén (H).
öt szén-aldehid D – és L-cukor (Aldopentózis)
a lista legismertebb neve a ribóz, amely a ribonukleinsav (RNS) cukorgerince.
az alábbi ábra bal oldalán az L-aldopentózisok vannak, amelyek mindegyike ugyanazt a konfigurációt osztja meg az alsó sztereocenterrel, amikor az aldehidet a tetejére helyezzük.,
enantiomerjeik, a D-aldopentózisok a jobb oldalon vannak, amelyek mindegyike azonos konfigurációval rendelkezik az alsó sztereocenterrel (kiemelve).
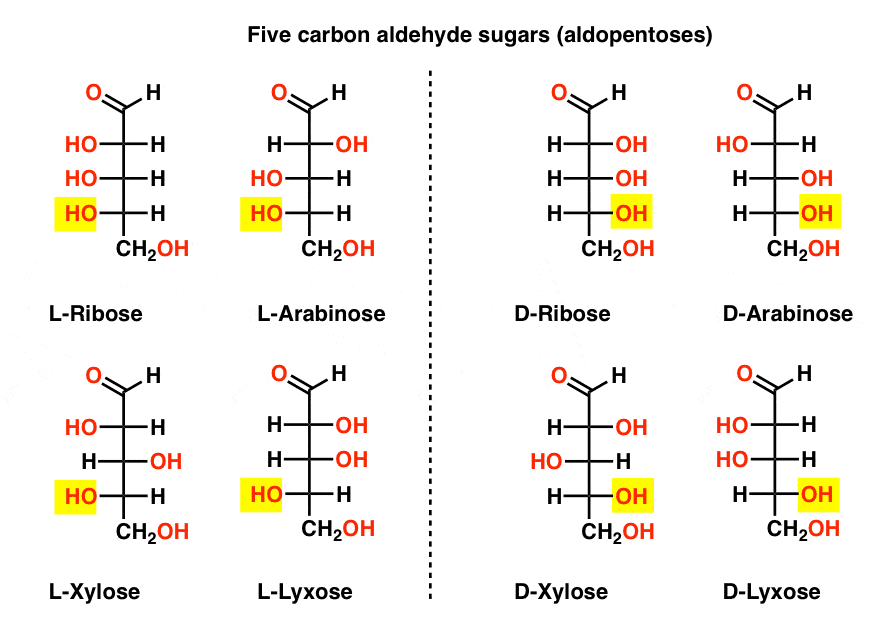
Ezen a ponton meg kell mutatnunk, hogy a földi életformákban a cukrok túlnyomó többsége D-cukrok, beleértve a D – ribózt is, mint az RNS gerincét. Hogy miért és hogyan került a Föld összes élőlénye a D-cukrokba, rejtély, hiszen az ember azt feltételezi, hogy az L-cukrok is ugyanúgy működtek volna.,
hat szén-aldehid D – és L-cukor (Aldohexózis)
ha 4 aldopentózis van, mindegyik D – L-pár enantiomerként (összesen 8 sztereoizomer), akkor hány aldohexózis van?
8 D-L-pár van (összesen 16 sztereoizomer). A legismertebb a glükóz, de valószínűleg felismeri a mannózt és a galaktózt. Néhányan ritkán, ha valaha is megtalálhatók a természetben (idose, bárki?).
itt vannak a D-aldohexózisok. Vegye figyelembe, hogy mindegyiknek ugyanaz a konfigurációja van az alsó királis központnak-ugyanaz, mint amit a D-gliceraldehidben láttunk.,
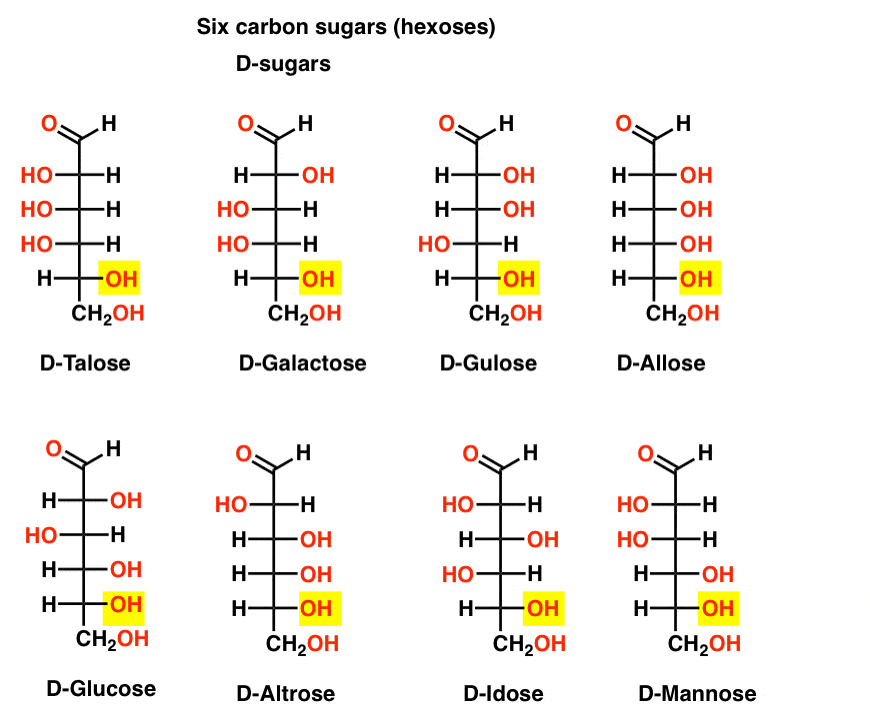
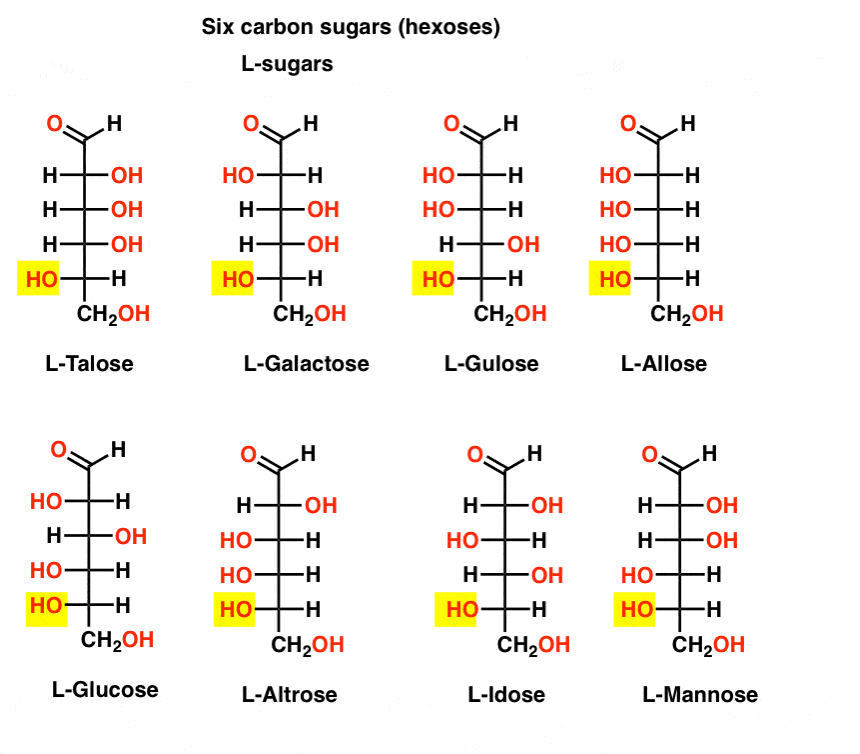
ellentétben a D-cukrokkal, az L – cukrok (lent) ritkán találhatók a természetben. Érdekes módon az L-glükózt cukorhelyettesítőként vizsgálták. Íze megkülönböztethetetlen a természetben előforduló D-glükóztól, de nem biztosít táplálékot, mivel a (királis) enzimek nem bontják le. Mint kiderült, a termelés csak túl drága, hogy versenyezni splenda, stevia, aszpartám et. al.
OK, ez elég. Hét széntartalmú cukrok készültek (aldoheptózisok), de biológiailag nem jelentősek.,
7. De várj-van még! (Aminosavak)
Ha a Fischer-vetületben aminosavakat rajzol a tetején a leginkább oxidált csoporttal (a karbonsav), akkor l – és D-is hozzárendelhető.
a fehérjékbe beépített 19 királis aminosav közül (a proteinogén a megfelelő kifejezés) mind L- . (A glicin achirális, tehát a D-és L – nem alkalmazható). Egyes D – aminosavak természetesen előfordulnak, de ritkák (többnyire baktériumokban találhatók, kivéve a kacsacsőrű mérget), és az mRNS nem kódolja őket.,
érdekes módon, bár mind a 19 királis aminosav L- , a 19-ből csak 18 (S). Mi a kivétel?
(Ez jó szerves kémia Bar trivia).
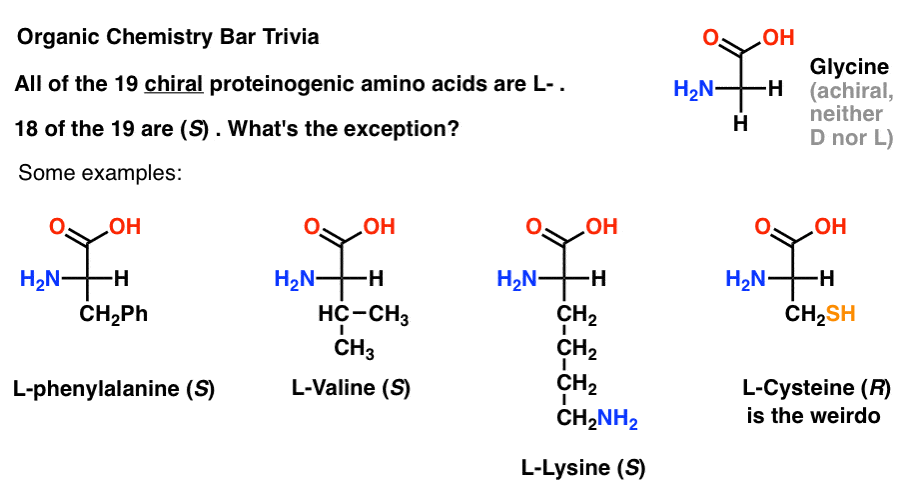
a cisztein a furcsa.
(bónusz pontokat, ha azt is mondta selenocisztein … majom).
összefoglaló: D – és L-jelölés cukrokra és aminosavakra
tehát ez a D – L-rendszer az abszolút konfiguráció hozzárendeléséhez. Ez jól működik a cukrok, mivel lehet építeni, így szisztematikusan (mint a bináris rendszer). Az aminosavak számára is hasznos., A lényeg csak az, hogy megnézzük az alsó sztereocentrumot, miközben a Fischer-vetületben rajzolják. Igaz? D. Balra? L.
természetesen a cukrok nem mindig olyan segítőkészek a Fischer-vetületekben-gyűrűket alkotnak. A D – és L – in ciklikus cukrok meghatározásáról egy későbbi bejegyzésben fogunk írni.
csak annyit kell mondanom, köszönöm, amit istenség úgy dönt, hogy hisz abban, hogy Fischer kitalálása helyesnek bizonyult. Óriási fájdalom lenne, ha a kémiai szakirodalom 70+ évét átszitálnánk azzal a tudattal, hogy rossz konfigurációt rendeltek az összes cukrhoz és aminosavhoz.,
köszönet Thomas Struble segítséget ebben a bejegyzésben.
Megjegyzések
1. Megjegyzés. “a legtöbb királis cukrban az utolsó előtti sztereocentrum R, míg a legtöbb aminosavban a sztereocentrum S” nem teljesen azonos gyűrűvel rendelkezik, különösen mivel a cisztein R. ]
Megjegyzés. Itt egy gondolatkísérlet az erythrose és a threose relatív konfigurációjának meghatározására., (Azt mondom, hogy “gondolatkísérlet”, mert nem akarok olyan speciális reagenseket felvenni, amelyek elvonhatják a figyelmet)
Ha az ember tiszta (+)- erythrose-val kezdődik, és az elsődleges alkoholt ismert módszerekkel aldehiddé oxidálja, az egyik olyan vegyületet kap, amelynek nincs optikai forgatása. Ugyanez igaz a ( – ) – erythrose-ra, amely teljesen azonos vegyületet ad vissza. Ebből arra lehet következtetni, hogy az új vegyület szerkezetének olyannak kell lennie, hogy a molekulának belső tükörsíkja legyen (azaz mezo). .,
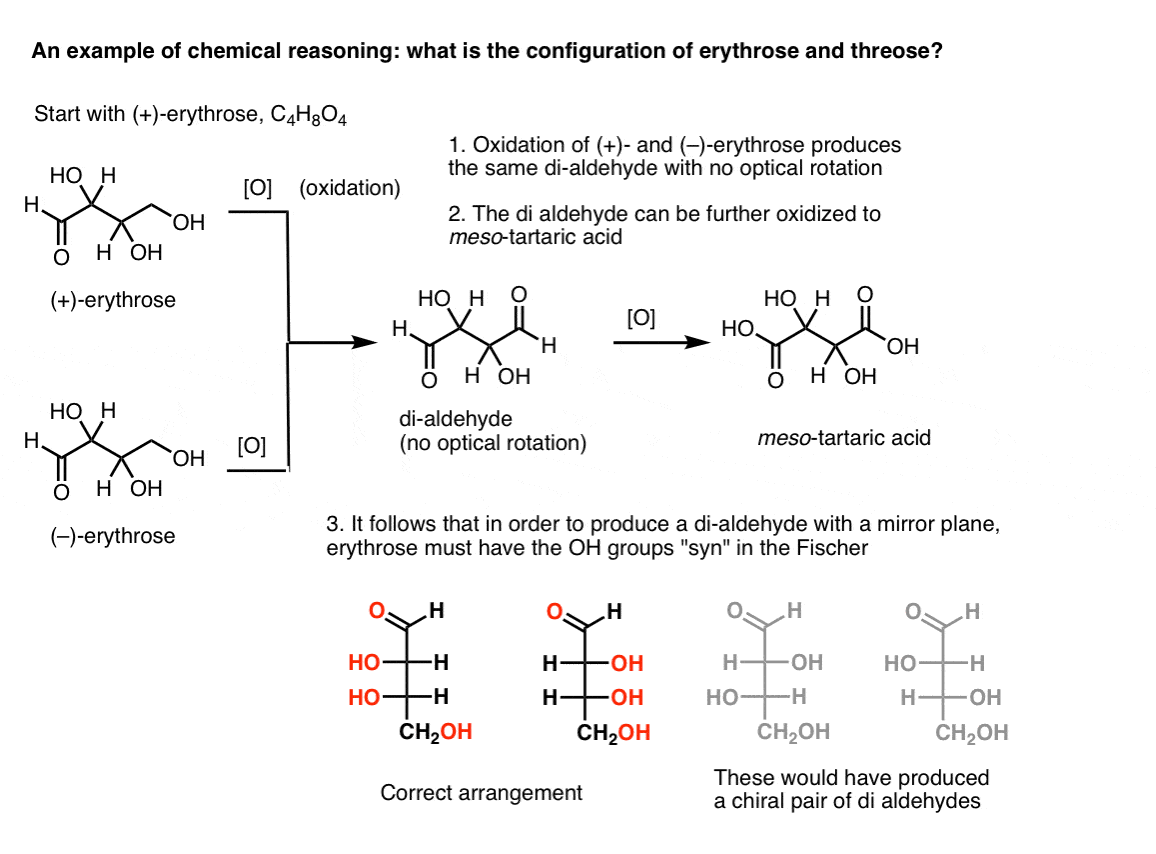
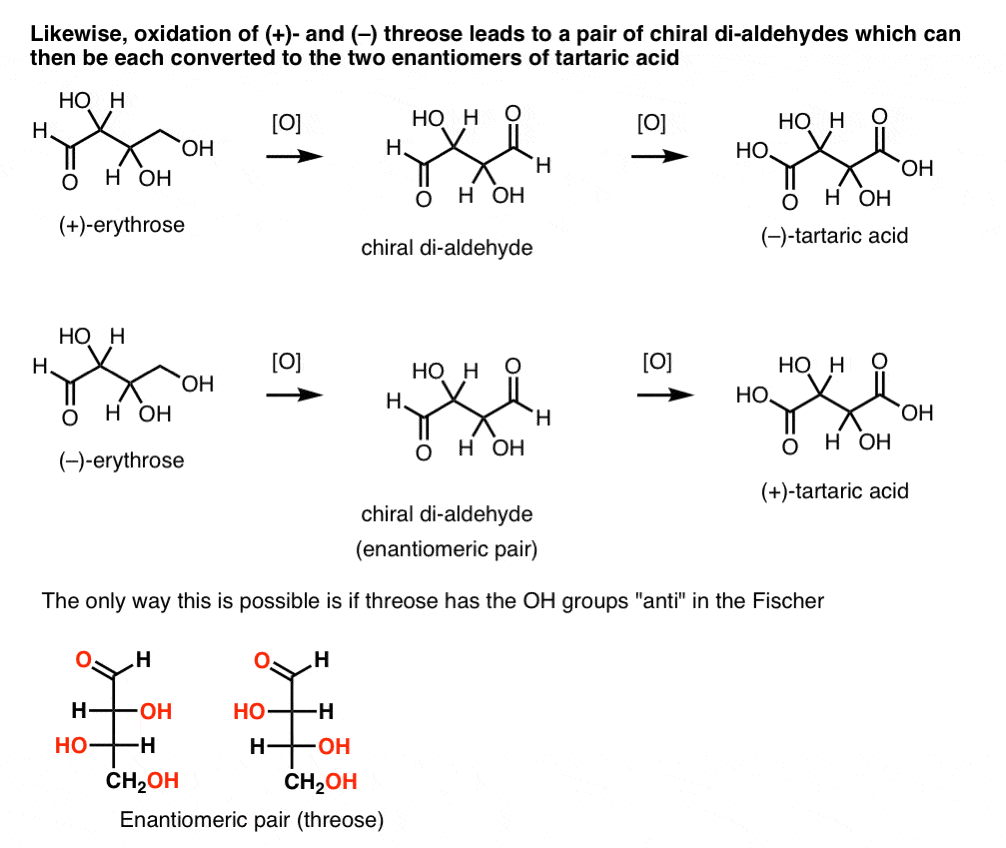
ezzel szemben ugyanazt a műveletet (+)-a hármas di-aldehidet eredményez, amely fenntartja az optikai forgatást. Egy egyenlő és ellentétes optikai forgással rendelkező vegyületet úgy alakítanak ki, hogy ugyanazt a műveletet (–)-hármasra hajtják végre. Ez a két vegyület enantiomer. Annak érdekében, hogy ez igaz legyen, a háromrészes hidroxilcsoportok relatív orientációjának anti-nek kell lennie. Ezek a vegyületek tovább oxidálhatók, hogy (–)- és (+)- borkősavat termeljenek.,
ugyanaz az érvelés használható az ellenkező irányba (redukció). Például vagy ( + ) – vagy ( – ) – erythrose csökkenthető a tetra-ol eritritolra, amely mezo.
Hasonlóképpen, a (+)- és (–) hármasok csökkenése enantiomer tetra-ols, threitol pár kialakulását eredményezi.
ezekből a tényekből levonhatjuk az OH csoportok relatív orientációját.
(haladó) referenciák és további olvasmányok
- Über die Bezeichnung von optischen Antipoden durch die Buchstaben D und l
Emil Fischer
Ber. 1907, 40 (1), 102-106
DOI: 10.,1002 / cber.19070400111
Ez a híres papír, ahol Prof. Emil Fischer (önkényesen!) rendelt ( – ) – gliceraldehid az L-sztereokémia. - Szintézise a Purin Cukor Csoport
Emil Fischer
Nobel-Előadás, 1902-benFischer Nobel-Előadás, ahol arról beszél, hogy a munka nem csak a szénhidrátok, hanem a purin, amely vegyületek, mint a koffein, teobromin tagja. Prof. Fisher az energiaitalok emelkedését jósolja (pl., Red Bull), kijelentve: “egy kis képzelet gyakorlásával várható a nap, amikor a babnak már nem lesz szüksége a jó kávé készítésére:egy kis mennyiségű por a vegyszerből vízzel együtt működik, meglepően olcsó ízletes, frissítő italt biztosít”.
- optikailag aktív vegyületek abszolút konfigurációjának meghatározása röntgensugarak segítségével
BIJVOET, J., PEERDEMAN, A. & van BOMMEL, A.,
Természet 1951, 168, 271-272
DOI: 1038/168271a0
a híres papír, amely röntgen szerkezeti elemzéssel bizonyította, hogy “Emil Fischer konvenciója, amely a Fig konfigurációját rendelte el. 2 a dextrorotációs savhoz, úgy tűnik, hogy válaszol a valóságra”. - Emil Fischer felfedezése a glükóz konfigurációjáról. A semicentennial retrospect
C. S. Hudson
Journal of Chemical Education 1941, 18 (8), 353
DOI: 10.1021/ed018p353
egy korai felülvizsgálat, amely magában foglalja Prof. Emil Fischer munkáját szénhidrát kémia., - Emil Fischer igazolása a cukrok konfigurációjáról: Centennial Tribute
Frieder W. Lichtenthaler
Angew. Chem. Int. Ed. 1992, 31 (12), 1541-1556
DOI: 10.1002/anie.199215413
egy nagyon olvasható áttekintés 1992-ből, amely Prof. Fischer szénhidrátkémiai munkásságát fedi le, és mélyreható betekintést nyújt a szénhidrátok sztereokémiai feladataiba.
