Bevezetés a karbonil csoport
A szerves kémia, karbonil csoport funkcionális csoport, ahol a szén-oxigén atom kapcsolódik egy kettős kötést. A karbonilcsoportot tartalmazó vegyületek karbonilvegyületekként ismertek. A karbonilcsoport olyan szén-monoxidra utal, amely egy szervetlen atomhoz is kapcsolódhat, mint egy ligandum, amelyet fém-karbonilnak neveznek, például nikkel-karbonil.,
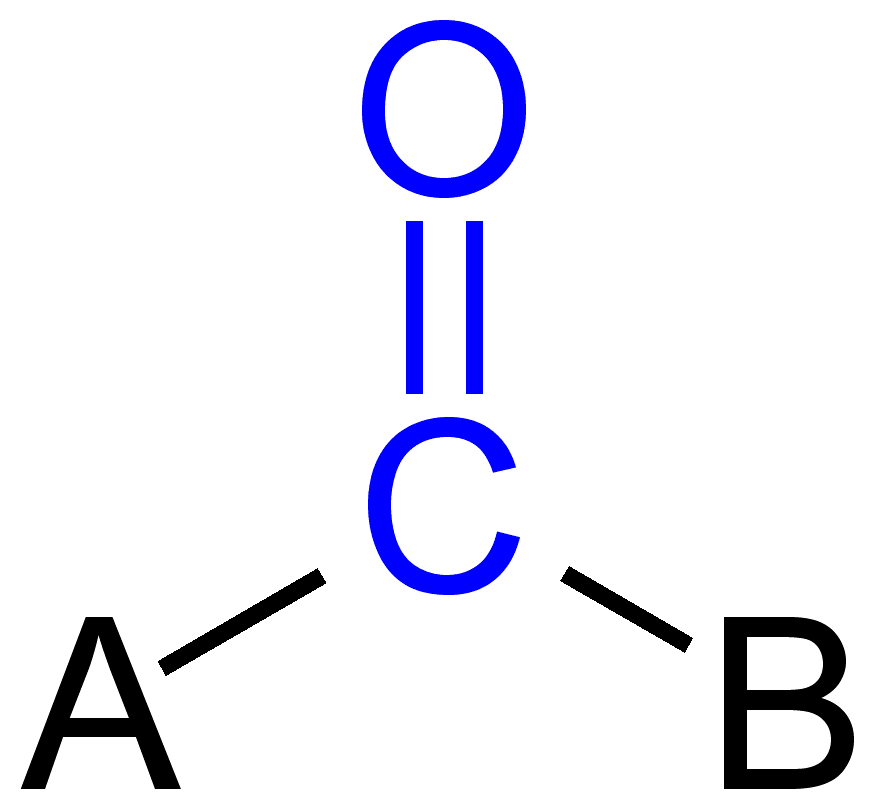
egyes karbonilcsoportok
kettős kötés a karbonilcsoportban
a karbonilcsoportban a szén-és oxigénatom általában sp2 hibridizálódik, így plannar. Az oxigén elektronegatív atomként való jelenléte miatt a karbonilcsoportban a kettős kötés különbözik az alkénekben a reaktivitás szempontjából. A több Elektronegativitás és két magányos elektronpár jelenléte miatt az oxigén részlegesen negatív töltéssé válik, míg a karbonilszén részlegesen pozitív töltést generál, így polaritás figyelhető meg.,
karbonil rezonancia szerkezet
az oxigén elektronegatív atomként való jelenléte miatt a karbonilcsoport rezonancia struktúrát mutat. A karbonilcsoport rezonancia szerkezete befolyásolja a vegyület reaktivitását. Minél elektronegatívabb oxigénatom távolítja el az elektronokat a szénközponttól, a karbonil-szén részlegesen elektropozitívvá, az oxigén pedig részlegesen elektronegatívvá teszi. Így a polaritás a karbonilvegyületen belül keletkezik.
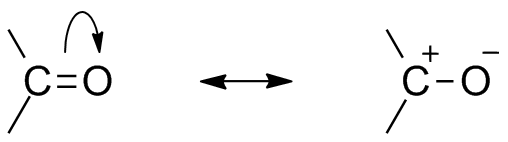
ezt az elektropozitív karbonil-szenet vagy elektrofilt most egy nukleofil támadhatja meg.,
Reaktivitás
Karbonil Alkilezés
Alkilezés a karbonil csoport által nucleophilic kívül reakció segítségével Grignard-reagens jelennek meg a következők szerint: 
Fizikai tulajdonságai karbonil vegyületek
- A forráspont a aldehidek, valamint ketonok magasabb, mint a forráspont az éterek, valamint alkánok hasonló molekuláris tömege.
- ismét az aldehidek és ketonok forráspontja alacsonyabb, mint a megfelelő alkoholoké.,
- sok magasabb aldehid kellemes illatú, parfümökben vagy mesterséges ízesítőként használják, míg homológ sorozatuk alsó tagja csípős szagú.
- a magasabb ketonok szagtalan szagúak, az alacsonyabbak kellemes szagúak, mint például az aceton.
- A Kis aldehidek és ketonok vízben oldódnak, de a lánchossz növekedésével az oldhatóság csökken.
- a van der Waals diszperziós erők erősebbé válnak, ahogy a molekulák hosszabbodnak.,
H-kötés karbonilcsoportba
a karbonil oxigén és a vízmolekula hidrogénje közötti H-kötés kialakulása miatt az alsó karbonilvegyületek vízben oldódnak. De ahogy a lánc nő, úton van, hogy hidrogénkötést képezzen, és az oldhatóság csökken.
Van der Waals dipól-dipól attrakció
a karbonilcsoport polaritása és a diszperziós erők jelenléte miatt két közeli molekula vonzódik egymáshoz. Ez azt okozza, hogy a karbonilvegyületek forráspontja magasabb, mint a megfelelő alkánok., Az alábbi táblázatban látható, hogy a karbonilvegyületek forráspontja magasabb, mint a megfelelő alkánok, és alacsonyabb, mint az alkoholok.,v>Boiling point (o C)
Spectroscopy
Infrared spectroscopy
The absorption of carbonyl group depends on the geometry of the molecule., Általában az infravörös fény abszorpciója hullámhosszon mutatkörülbelül 1600-1900 cm−1 (5263 nm-6250 nm).
magmágneses rezonancia
a karbonil-szén szén szén-NMR-je körülbelül 160-220 ppm közötti csúcsot mutat.
