BEISPIEL – Vorhersage Molekulare Polarität:
Decidewhether die Moleküle dargestellt durch die folgenden Formeln sind polar ornonpolar. (Möglicherweise müssen Sie Lewis-Strukturen und geometrische Skizzen zu doso zeichnen.)
ein. CO2 b. OF2 c. CCl4 d. CH2Cl2 e. HCN
Lösung:
ein. Die Lewis-Struktur für CO2
Die electronegativities of carbon und oxygenare 2.55 und 3.44. Die 0.,Der Unterschied in der Elektronegativität zeigt an, dass dieC-O-Bindungen polar sind, aber die symmetrische Anordnung dieser Bindungen machtdas Molekül unpolar.
Wenn wir Pfeile in die geometrische Skizze für CO2 einfügen, sehen wir, dass sie sich in beide Richtungen genau ausbalancieren undmagnitude. Dies zeigt die Symmetrie der Bindungen.
b., Die Lewis-Struktur für OF2 ist
Die Elektronegativitäten von Sauerstoff und Fluor,3,44 bzw. Die molekulare geometrie von OF2 ist gebogen. Eine solche asymmetrische Verteilung polarer Bindungen würde ein polares Molekül erzeugen.
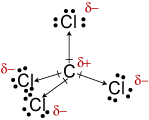
c. Die molekulare geometrie von CCl4 istetrahedral., Obwohl die C-Cl-Bindungen polar sind, macht ihre symmetrische Anordnung das Molekül unpolar.
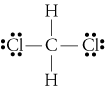
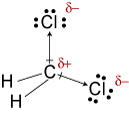
d. TheLewis Struktur für CH2Cl2, ist
Die electronegativities von Wasserstoff, Kohlenstoff, andchlorine werden 2.20, 2.55, und 3.16. Der 0,35 Unterschied in der Elektronegativität fürDie H-C-Bindungen sagen uns, dass sie im Wesentlichen unpolar sind. Die 0.,61differenz in der Elektronegativität für die C-Cl-Bindungen zeigt, dass sie unpolar sind. Die folgenden geometrischen Skizzen zeigen, dass die polaren Bindungen sindasymmetrisch angeordnet, so dass das Molekül polar ist. (Beachten Sie, dass die obige Lewisstruktur falsch darauf hindeutet, dass die Bindungen symmetrisch angeordnet sind.Denken Sie daran, dass Lewis-Strukturen oft einen falschen Eindruck von der Geometrievon den Molekülen, die sie darstellen.)

e., TheLewis Struktur und geometrische Skizze für HCN sind die gleichen:
Die Elektronegativitäten von Wasserstoff,Kohlenstoff und Stickstoff sind 2,20, 2,55 und 3,04. Die 0,35 Differenz Inelektronegativität für die H-C-Bindung zeigt, dass es im Wesentlichen unpolar ist. Der Unterschied in der Elektronegativität für die C-N-Bindung 0,49 sagt uns, dass es polar ist.Moleküle mit einer polaren Bindung, sind immer polar.