6.3 Hvordan er energi som er relatert til bølgelengden til strålingen?
Vi kan tenke på stråling, enten som bølger eller som individuelle partikler som kalles fotoner. Energi knyttet til en enkelt foton er gitt ved E = hv , der E er energi (SI-enheter J), h er plancks konstant (h = 6.626 x 10-34 J s), og ν er frekvensen av strålingen (SI-enheter av s–1 eller Hertz, Hz) (se figur nedenfor)., Frekvensen er i slekt å bølgelengde med λ=c/ν , der c, lysets hastighet, er 2.998 x 108 m s–1. En annen mengde som du vil ofte se er wavenumber, σ=1/λ, som er ofte rapportert i enheter av cm–1.
energien av et enkelt foton som har bølgelengde λ er gitt ved:
E = hc λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., Energien av en muldvarp av fotoner som har bølgelengde λ er funnet ved å multiplisere over ligning av Avogadro nummer:
E m E = hc N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
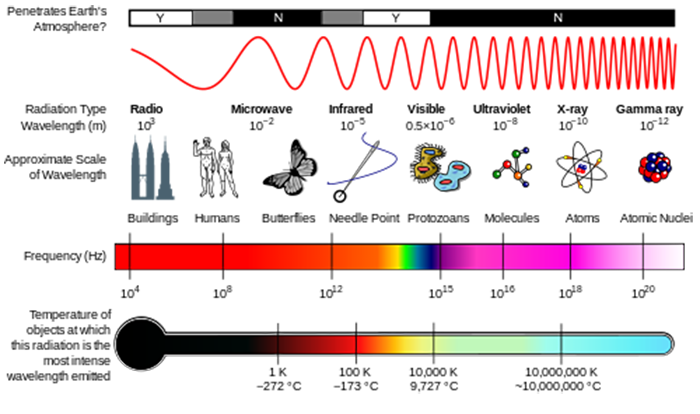
I leksjonen om atmosfærens sammensetning, som du så, hvor solens UV-stråling var i stand til å bryte fra hverandre molekyler for å starte atmosfærekjemi. Disse molekylene er å absorbere energien av et foton av stråling, og hvis det foton energi er større enn styrken av kjemisk binding, molekylet kan bryte fra hverandre.
Sjekk Din Forståelse
Vurdere reaksjonen O3 + UV → O2 + O*. Hvis binding mellom O2 og O – * (dvs.,, opphisset tilstand oksygen atom) er 386 kJ mol–1, hva er den lengste bølgelengden som et foton kan ha og fortsatt bryte denne bindingen?
SVAR: Løse for bølgelengden i ligningen
λ= 1.196 × 10 8 J nm mol -1 E m E = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
