D – Og L – Notasjon For Den Absolutte Konfigurasjon Av Sukker Og Aminosyrer
Det som skiller «D-Glukose» fra «L-Glukose» ? Eller D-alanin fra L-alanin?
Og hva er dette D – og L – nomenklaturen, likevel? Les videre:
Innholdsfortegnelse
- D – og L – Gir En Rask en Forkortelse For Utpeke Enantiomers
- Hvorfor skal Vi Bry seg Med Dette Gamle Nomenklatur?,
- L – Og D – System For å Tildele «Absolutt Konfigurasjon»
- Fire-Karbon Aldehyd D – og L – Sukker (Aldotetroses)
- Fem-Karbon Aldehyd D – og L – Sukker (Aldopentoses)
- Seks-Karbon Aldehyd D – og L – Sukker (Aldohexoses)
- Men Vent – Det er Mer! (Aminosyrer)
- Oppsummering: D – og L – Notasjon For Sukker og Aminosyrer
- Notater
- (Avansert) Referanser og Videre Lesing
D – Og L – Gir En Rask en Forkortelse For Utpeke Enantiomers
D – og L – notasjon gir en rask en forkortelse for utpeke enantiomers.,
D-Glukose er nedbrytingen av L-Glukose, for eksempel. Som L-Alanin er nedbrytingen av D-Alanin.
Det er tildelt som følger. For en sukker trukket i Fischer-projeksjon med de mest oksidert karbon på toppen (dvs. aldehyd eller keton)
- hvis det er null på bunnen chiral sentrum poeng til høyre, er det referert til som D-
- hvis det er null på bunnen chiral sentrum poeng til venstre, er det referert til som L- .
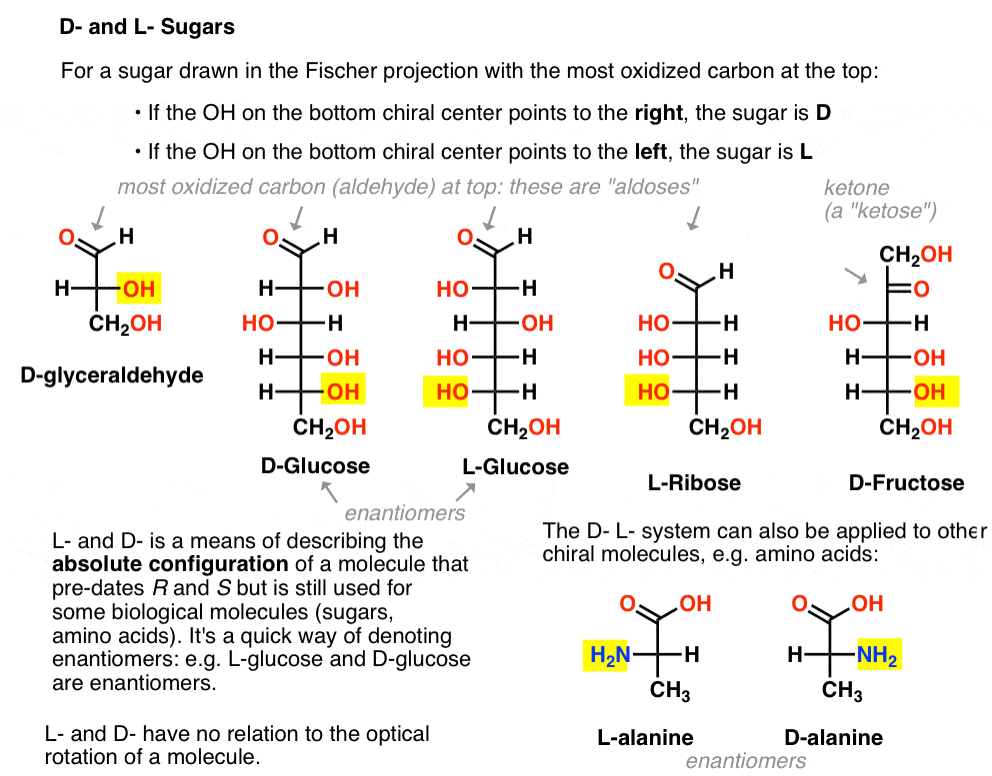
Denne terminologien kan også brukes til aminosyrer: se L – og D – alanin i bildet ovenfor.,
2. Hvorfor Skal Vi Bry Seg Med Dette Gamle Nomenklatur?
Du kan med rette spørre: er vi ikke allerede har et system for å tildele absolutt konfigurasjon ? Hvorfor trenger vi et nytt system?
D-L-system er ikke et nytt system, folkens. Det er det gamle systemet – det forut Cahn-Ingold-Prelog.
D-L-system er bokstavelig talt en rest av hest-og-kjerre-tiden, og kan dateres tilbake til Emil Fischer ‘ s arbeid på karbohydrater i slutten av 1800-tallet – en tid da organiske kjemikere hadde ingen måte å finne ut det absolutte konfigurasjon av stereocenters, som bare ble mulig i 1951 (thx, Bijvoet).,
Så hvorfor er det fortsatt bli brukt? Bør ikke det være henvist til historiens, sammen med skyv regler, 8-spors kassetter, og 5 ¼ » disketter?
Vel, det er blomstrende lokalsamfunn i deler av distrikts-Amerika, der hestevogner vedvare – hvis du vet hvor du skal lete. (Kanskje en dag vil det være kommuner der folk bare bruke 1970-og 1980-tallet datateknologi?)
på samme måte er det en lomme i organisk kjemi der D-L systemet fortsatt finner bruk, og som er spesielt i riket av sukker og aminosyrer.,
Dette er ikke et opprør av Amish-kjemikere mot den moderne onder av CIP-systemet, forresten. Det er minst 3 gode grunner i det konkrete tilfelle av sukker og aminosyrer, for å bruke L – og D- :
- Kortfattethet. D-glukose er et helvete for en mye raskere å skrive og si enn (2R,3S,4R,5R)2,3,4,5,6-pentahydroxyhexanal. L-/D – system gir mulighet for konfigurasjon av et molekyl med flere chiral sentre til oppsummeres med en enkelt bokstav (i tillegg til sine vanlige navn, selvfølgelig – takk til Noel for påminnelsen)
- Mer kortfattethet., Det skjer for å være en rask måte å henvise til enantiomers. Den nedbrytingen av L-glukose er D-glukose. Den nedbrytingen av L-tryptofan er L-tryptofan. Og mens vi kunne bruke (+)- eller (–)- prefikser for å skille de to enantiomers av glukose og andre sukkerarter, tegnet av optisk rotasjon kan variere med løsemiddel, temperatur, konsentrasjon, og andre faktorer som gjør det mindre enn ideell. Plus, L – og D – referere spesifikt til absolutt konfigurasjon, mens (som vi har nevnt tidligere) det er ingen enkel sammenheng mellom tegn på optisk rotasjon og konfigurasjon.,
- Det viser seg at de fleste naturlig forekommende sukker er D-, og de fleste naturlig forekommende aminosyrer er L- . Det er en enorm mengde informasjon som er komprimert i denne uttalelsen, og det er ingen konkurrerende system (R/S, +/–) som kunne erstatte den L – og D – med et enkelt tegn. Merk
Det er verdt å gjenta: med sukker og aminosyrer, L – og D – kan være nyttig betegnelser. For andre molekyler, kan du stort sett glemme det.
Så hva er dette D-/L – system, og hvordan disse vilkårene knyttet til struktur?,
Bli med meg når vi reiser tilbake i tid for…
L – Og D – System For å Tildele «Absolutt Konfigurasjon»
Emil Fischer begynte å studere karbohydrater i slutten av 1880-tallet. Det var kjent den gang (via Van ikke Hoff) at utslippene var tetrahedral, og det ble også kjent at molekyler som inneholder karbon med fire forskjellige substituenter kunne rotere plan-polarisert lys (f.eks. Pasteur). Det var ikke kjent var den absolutte konfigurasjon av noen av chiral molekyler – hva vi ville se i dag som deres «R» og «S» – konfigurasjoner.,
Den enkleste karbohydrater inneholder en chiral center er glyceraldehyde, C3H6O3. Glyceraldehyde har tre karbonatomer, noe som gjør det til en «triose». Den mest oksidert karbon i glyceraldehyde er et aldehyd, som også gjør det til et «aldose».
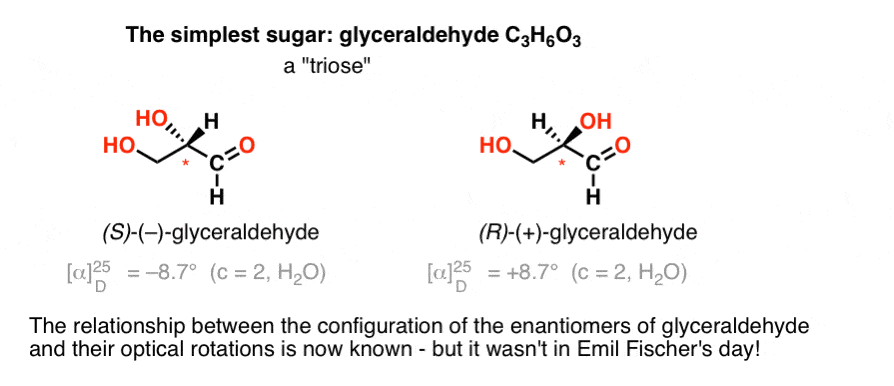
I 1888, de to enantiomers av glyceraldehyde hadde blitt isolert og karakterisert., Men siden det er ingen enkel sammenheng mellom konfigurasjonen av en chiral sentrum og i hvilken retning den roterer plan-polarisert lys, Emil Fischer hadde ingen måte å binde tilbake optisk rotasjon av (+)- og (–)-glyceraldehyde til den absolutte konfigurasjon av atomer rundt chiral sentrum.
ved Hjelp av dagens terminologi, hadde han ingen mulighet for å vite om (–)-glyceraldehyde var (R) eller (S).
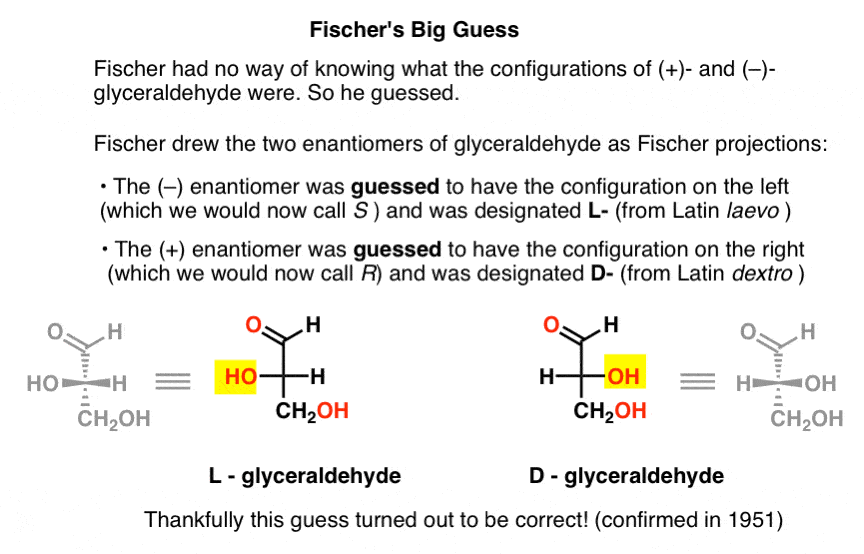
Mangler denne tasten stykke informasjon, Fischer valgte å gjette.,
Den antar, som viste seg å være riktig, var at (–)-glyceraldehyde hadde konfigurasjonen vi nå kaller S, og at (+)-glyceraldehyde har konfigurasjonen vi nå kaller R.
selvfølgelig, Cahn, Ingold, og Prelog ikke hadde blitt født ennå, og CIP-systemet ville bare bli utviklet etter Bijvoet arbeid i 1951. Så Fischer utviklet sin egen nomenklatur.
Tegning glyceraldehyde i det som senere skulle bli kalt Fischer projeksjon, han tildelt konfigurasjon på menyen til venstre (–)-glyceraldehyde, og kalte det L- (kort for Latin-laevo )., Han så tildelt konfigurasjonen til høyre (+)-glyceraldehyde, og kalte det for D- (for Latin-dextro ).
Hvorfor er dette så viktig?
Tilordne den absolutte konfigurasjon for L – og D – glyceraldehyde var litt som å tilordne nullmeridianen (0° lengde) til Royal Observatory i Greenwich, England., Akkurat som lengdegrad av ethvert annet sted på jorden vil da kunne fastsettes i forhold til det punktet hvis deres relative avstander ble kjent, den absolutte konfigurasjon av hver andre stereocenter kan da bestemmes hvis konfigurasjonen i forhold til L – eller D – glyceraldehyde ble kjent.
Det kan ikke være den klareste analogi. Så la oss se på det 4-karbon sukker for et annet eksempel.,
Fire Karbon Aldehyd D – og L – Sukker (Aldotetroses)
Når absolutt konfigurasjoner av L – og D – glyceraldehyde ble foreslått, den absolutte konfigurasjoner av andre chiral compounds kan da være etablert ved analogi (og en rekke kjemiske grynt arbeid).
Det er ikke avgjørende for i dag, men for et eksempel på denne typen argumentasjon, se dette .
Tilbake når begrepet chiral sentre ble innført, har du sannsynligvis lært at et molekyl med n chiral sentre vil ha 2n stereoisomers (så lenge det ikke er noen meso forbindelser).,
Det er to fire-karbon aldoses, threose og erythrose. De har hver to chiral sentre. Hver eksistere som et par av enantiomers (L – og D- ) gir fire stereoisomers totalt.
Her er de. Det viktigste å huske på i figuren nedenfor er at L-familien av sukker har OH-gruppe i bunnen chiral karbon på venstre side, og D-familien har OH-gruppe i bunnen chiral karbon på høyre side (merket).,
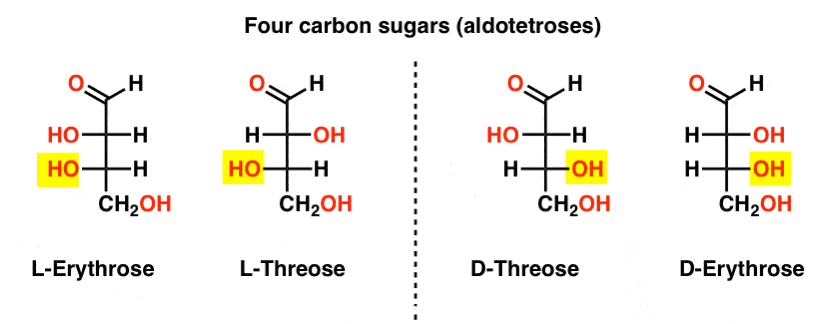
Se hvordan L-Erythrose-og L-Threose bygge på stereocenter etablert i L-glyceraldehyde (uthevet), og D-Erythrose-og D-Threose bygge på stereocenter etablert i D-glyceraldehyde (uthevet).
Sukker er bygget opp litt som det binære systemet, du kan tenke på hver stereocenter er en «bit» som kan ha én av to mulige verdier. Konfigurasjonen av L-erythrose-og L-threose bare skiller seg på ett stereocenter. Hvis vi skulle snu posisjonen til H og OH, ville vi få andre., Dette forholdet har et navn som du kan se noen ganger: to molekyler som har motsatt konfigurasjon på bare ett stereocenter er kalt epimers, spesielt når en av atomer som er festet til stereocenter er en hydrogen (H).
Fem Karbon Aldehyd D – og L – Sukker (Aldopentoses)
Den mest kjente navn på listen bør være ribose, som er sukker ryggraden i ribonucleic acid (RNA).
På venstre side i diagrammet nedenfor har vi L-aldopentoses, som alle deler den samme konfigurasjonen av bunnen stereocenter når aldehyd er plassert på toppen.,
Deres enantiomers, D-aldopentoses, er på høyre side, som alle deler den samme konfigurasjonen av bunnen stereocenter (uthevet).
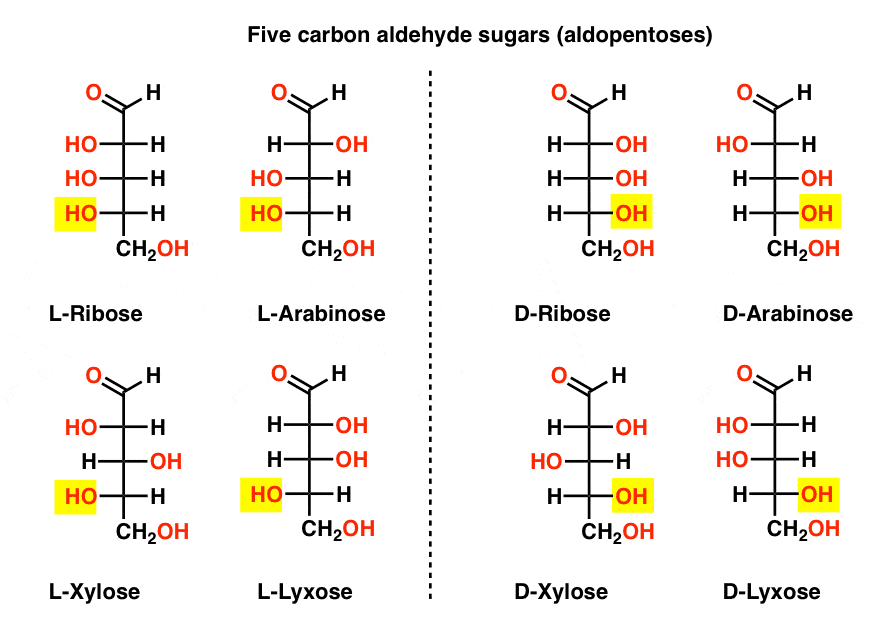
På dette punktet bør vi påpeke at det overveldende flertallet av sukker i Jord-basert livsformer er D – sukker, inkludert D-ribose som ryggraden i RNA. Hvorfor og hvordan alle organismer på jorden endte opp med D-sukker er et mysterium, som man forutsetter at L-sukker ville ha fungert like bra.,
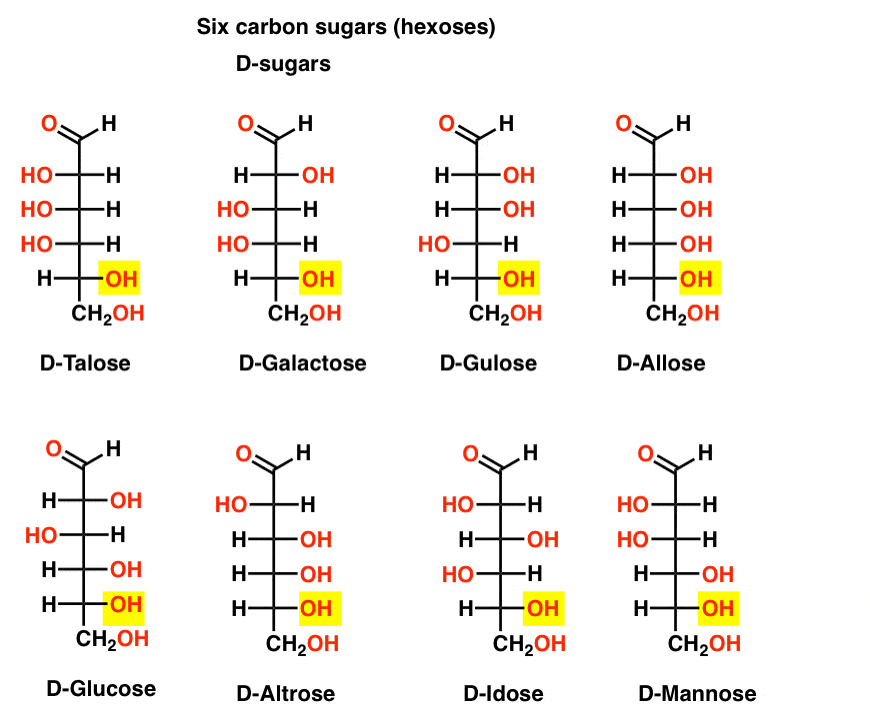
Seks Karbon Aldehyd D – og L – Sukker (Aldohexoses)
Hvis det er 4 aldopentoses, hver som en D – L – par enantiomers (8 stereoisomers totalt) deretter hvor mange aldohexoses er det?
Det er 8 D-L – par (16 stereoisomers totalt). Den mest kjente er glukose, men vil du sannsynligvis kjenne igjen mannose og galaktose. Noen er sjelden, hvis noen gang, som finnes i naturen (idose, noen?).
Her er D-aldohexoses. Legg merke til hvordan de har alle den samme konfigurasjonen av bunnen chiral sentrum – det samme som vi så i D-glyceraldehyde.,
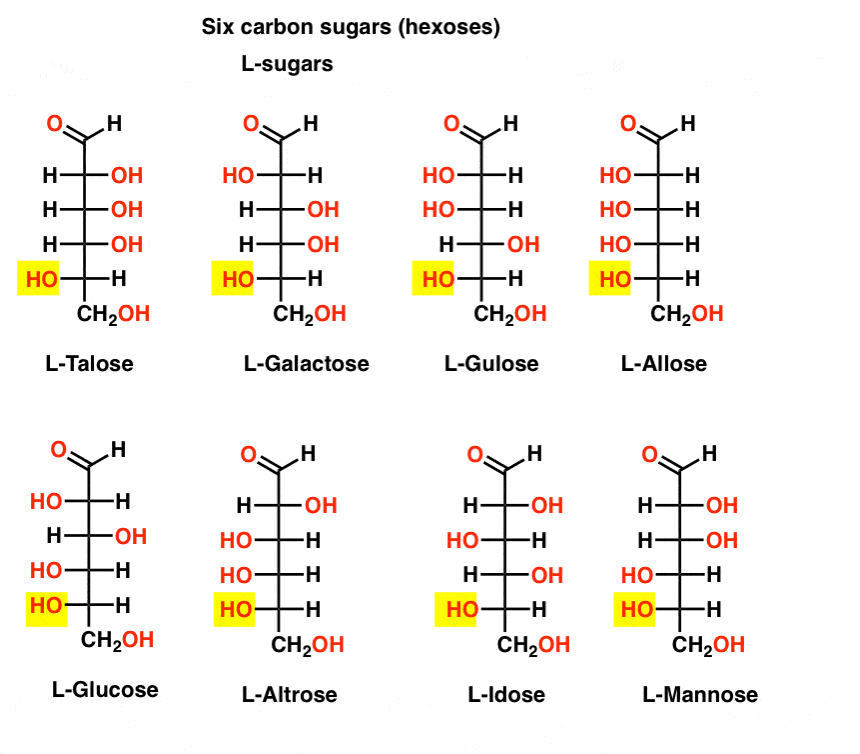
I motsetning til D-sukkerarter, L – sukker (nedenfor) er sjelden funnet i naturen. Interessant, L-glukose har blitt utforsket som en sukker erstatning. Smaken er umulig å skille fra naturlig forekommende D-glukose, men gir ingen næring siden det kan ikke bli brutt ned av vår (chiral) enzymer. Det viser seg at produksjonen er for kostbart til å konkurrere med splenda, stevia, aspartam et. al.
OK, det er nok. Sju-karbon sukker har blitt gjort (aldoheptoses), men de er ikke biologisk betydelig.,
7. Men Vent – Det er Mer! (Aminosyrer)
Hvis du tegner aminosyrer i Fischer-projeksjon med de mest oksidert gruppe på toppen (karboksylsyre) så kan du også tildele L – og D-.
Av 19 chiral aminosyrer som inngår i proteiner (proteinogenic er den riktige betegnelsen) er alle L- . (Glycine er achiral, så D – og L – gjelder ikke). Noen D – aminosyrer er naturlig forekommende, men de er sjeldne (for det meste funnet i bakterier, med unntak av platypus venom) og er ikke kodet av mRNA.,
det er Interessant, selv om alle 19 chiral aminosyrer er L – bare 18 av 19 (S). Hva er det unntak?
(Dette er bra organisk kjemi bar trivia).
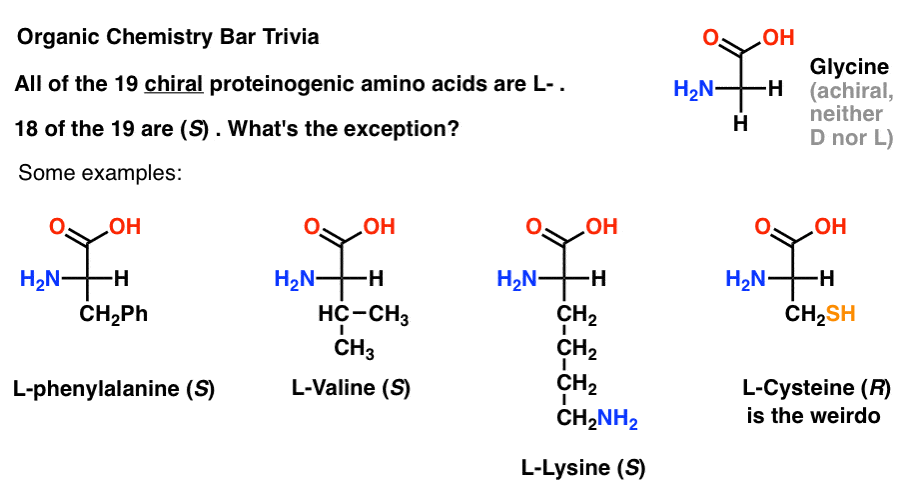
Cystein er weirdo.
(Bonus poeng hvis du sa også selenocysteine … nerd).
Oppsummering: D – og L – Notasjon For Sukker Og Aminosyrer
Så det er D – L – system for tildeling av absolutt konfigurasjon. Det fungerer godt for sukker, siden de kan være bygget opp slik systematisk (som det binære systemet). Det er også nyttig for aminosyrer., Nøkkelen er bare å se på bunnen stereocenter mens det er trukket i Fischer-projeksjon. Høyre? D. Venstre? L.
selvfølgelig, sukker er ikke alltid så hjelpsomt trukket i Fischer anslag – de danner ringer. Vi vil skrive om fastsettelse av D – og L – i syklisk sukker i en fremtidig innlegg.
Alt jeg har å si er, takk uansett hvilken gud du velger å tro på at Fischer antar viste seg å være riktig. Det ville være en enorm smerte i rumpa til å sile gjennom 70+ år av den kjemiske litteraturen å vite at det er galt konfigurasjon hadde blitt tildelt til alle sukker og aminosyrer.,
Takk til Thomas Struble for å få hjelp med dette innlegget.
Notater
Merk 1. «den nest siste stereocenter i de fleste chiral sukker er R, mens stereocenter i de fleste aminosyrer er S» ikke har helt den samme ringen, spesielt siden cystein er R. ]
Merk. Her er et tenkt eksperiment for å bestemme den relative konfigurasjoner av erythrose og threose., (Jeg sier «tanke-eksperiment» fordi jeg ikke ønsker å inkludere spesifikke reagenser, som kan være distraherende)
Hvis man starter med ren (+)-erythrose og oxidizes primær alkohol til et aldehyd ved bruk av kjente metoder, får man et sammensatt mangler optisk rotasjon. Det samme gjelder for (–)-erythrose, som gir en helt identisk stoff. Fra dette kan det utledes at strukturen av den nye forbindelsen må være slik at molekylet har en innvendig speil-fly (dvs. det er meso). .,
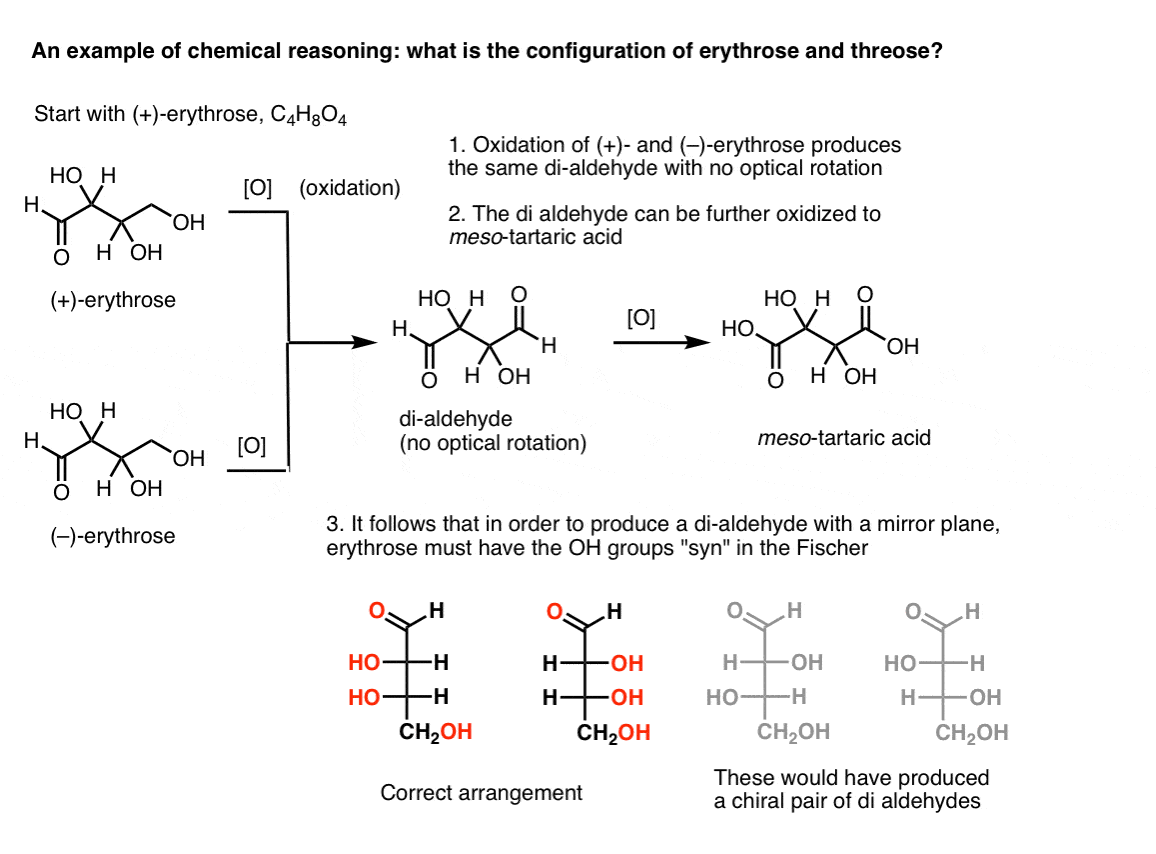
I motsetning til å utføre den samme operasjonen på (+)-threose resulterer i en di-aldehyd som opprettholder optisk rotasjon. Et sammensatt med like stor og motsatt rettet optisk rotasjon er dannet ved å utføre den samme operasjonen på (–)-threose. Disse to forbindelsene er enantiomers. For at det skal være sann, er den relative retning av hydroksyl grupper i threose må være anti. Disse forbindelsene kan bli oksidert ytterligere å produsere, henholdsvis, ( – ) og (+)- tartaric acid.,
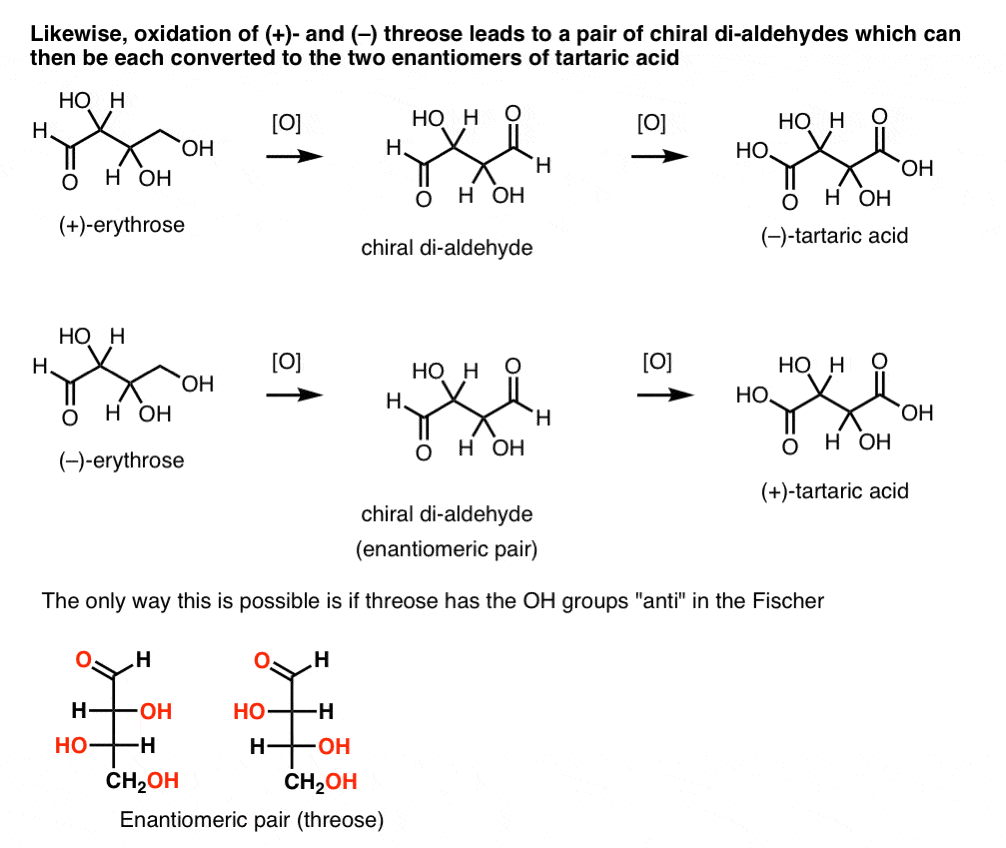
Det samme resonnementet kan brukes i motsatt retning (reduksjon). For eksempel enten (+)- eller (–)- erythrose kan reduseres til tetra-ol erythritol, som er meso.
på samme måte, reduksjon av (+)- og (–) threose resulterer i en enantiomeric par av tetra-ols, threitol.
Fra disse fakta, kan vi utlede den relative retning av OH-grupper.
(Avansert) Referanser og Videre Lesing
– >
- Über die Bezeichnung von optischen Antipoden durch die Buchstaben d l und
Emil Fischer
Farge. 1907, 40 (1), 102-106
TO: 10.,1002/cber.19070400111
Dette er den berømte papir hvor Prof. Emil Fischer (vilkårlig!) tildelt (-)-glyceraldehyde L-stereokjemi. - Synteser i Purin og Sukker Gruppe
Emil Fischer
nobelforedrag, 1902Fischer nobelforedrag, der han forteller om sitt arbeid ikke bare i karbohydrater, men også i puriner, av hvilke stoffer som koffein og teobromin er medlemmer. Prof. Fisher spår fremveksten av energidrikker (f.eks., Red Bull), som sier, «med utøvelse av litt fantasi dagen kan forutses når bønner vil ikke lenger være nødvendig å lage god kaffe: en liten mengde pulver fra en kjemisk fungerer sammen med vann vil gi en velsmakende, forfriskende drink overraskende billig».
- Bestemmelse av Absolutt Konfigurasjon av Optisk Aktive Forbindelser ved Hjelp av X-Stråler
BIJVOET, J., PEERDEMAN, A. & van BOMMEL, A.,
Natur 1951, 168, 271-272
TO: 1038/168271a0
Den berømte papir som viste seg, ved hjelp av X-ray strukturell analyse, at «Emil Fischer-konvensjonen, som er tilordnet konfigurasjonen av Fig. 2 til dextrorotatory syre, ser ut til å svare til virkeligheten». - Emil Fischer ‘ oppdagelse av konfigurasjonen av glukose. En semicentennial ettertid
C. S. Hudson
Journal of Chemical Utdanning 1941, 18 (8), 353
TO: 10.1021/ed018p353
En tidlig gjennomgang som dekker Prof. Emil Fischer arbeid i karbohydrat-kjemi., - Emil Fischer er et Bevis på Konfigurasjonen av Sukkerarter: En Centennial Hyllest
Frieder W. Lichtenthaler
Angew. Kem. Int. Ed. 1992, 31 (12), 1541-1556
DOI: 10.1002/anie.199215413
En svært lesbare anmeldelse fra 1992 som dekker Prof. Fischer arbeid i karbohydrat-kjemi og går i dybden i stereochemical oppdrag av karbohydrater.
