Innledning
Nosokomiale infeksjoner forårsaket av multidrug motstandsdyktig Acinetobacter baumannii er stadig mer vanlig over hele verden, spesielt i den intensive care innstilling (Wieland et al., 2018). Suksessen av denne bakterien er tilrettelagt av sin evne til å overleve i en rekke miljøer forsterket av den raske evne til å tilegne seg multidrug resistance. Overflaten karbohydrater spille viktige roller i den generelle egnethet og virulence av A., baumannii (Lees-Miller et al., 2013; Geisinger og Isberg, 2015; Weber et al., 2016). A baumannii produserer høy molekylvekt capsular polysakkarid (CPS) som omgir den ytre membran (Figur 1) (Russisk et al., 2010). Består av tett pakket gjenta oligosaccharide underenhetene (K-enheter), CPS danner en diskret lag på bakteriell overflate som gir beskyttelse fra ulike miljøforhold, bistå i evasion av vert immun forsvar, og økende resistens mot en rekke av antimikrobielle forbindelser (Russo et al., 2010; Iwashkiw et al., 2012; Geisinger og Isberg, 2015).,
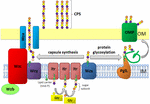
Figur 1. Skjematisk representasjon av kapsel polysakkarid montering og eksport i A baumannii. Syntese begynner med den første transferase (Itr; rødbrun) som ligger i den indre membranen (IM) overføre den første sukker av den repeterende enheten til en lipid carrier (Und-P; grønn sirkel). Påfølgende sukker er da lagt til den voksende enhet med bestemte glycosyltransferases (Gtr; gul) på cytosolic siden av den indre membranen., Kapselen subunit (K unit) er deretter overført til periplasm via integrert membran protein Wzx (mørk blå). Sukker underenhetene er polymerisert av Wzy protein (lilla) og Wza/Wzb/Wzc komplekse (cyan, lime, rød) koordinater høyt nivå polymerisasjon og eksport av den voksende kjeden, flytte dem til den ytre membran (OM). For glycosylation, PglL (oransje) linker K enheter på valgte ytre membran proteiner (OMP; mørk grønn).
I A baumannii, kapsel montering og eksport skjer via en Wzy avhengige av veien (Hu et al.,, 2013; Kenyon og Hall, 2013; Willis og Whitfield, 2013; Woodward og Naismith, 2016) (Figur 1). Vanligvis bestående av 4-6 sukker, K enheten er montert på lipid-carrier-molekylet undecaprenyl pyrophosphate (Und-P), som gir et stillas for den voksende sukker kjede (Whitfield, 2006). Den første sukker i K enheten er rekruttert av en indre membran (IM)-bundet første transferase (Itr), etterfulgt av de fortløpende tilsetting av sukker til den økende K-enhet med bestemte glycosyl transferase (Gtr) enzymer (Figur 1) (Woodward og Naismith, 2016)., Hver K enheten er deretter overført til periplasmic siden av CHAT ved Wzx translocase og polymeriserte med Wzy som overfører den voksende polysakkarid kjeden fra en Und-P transportør til neste innkommende subunit (Figur 1) (Collins et al., 2007). Etter CPS-polymer er syntetisert, det er transportert til celleoverflaten via et sterkt koordinert prosess som involverer interaksjon av tre proteiner; Wza, Wzb, og Wzc, som utgjør eksport av maskiner (Figur 1)., CPS-syntese representerer en arm av en splittnagler vei, som disse K enhetene er også brukt til å dekorere viss overflate proteiner via O-linket protein glycosylation (Lees-Miller et al., 2013). I dette tilfellet, enkelt K enheter er overført til mottakeren proteiner av O-oligosaccharyltransferase PglL (Figur 1) (Iwashkiw et al., 2012). I A. baumannii, protein glycosylation bidrar til dannelsen av biofilm ved å styrke første vedlegget og modning av biofilm, og pathogenicity som demonstrert i en rekke dyr infeksjon modeller (Iwashkiw et al., 2012; Scott et al., 2014; Harding et al.,, 2015). Biofilm er en vekst stat som bakteriell samfunn er innelukket i en exopolysaccharide matrise, og har vist seg å spille en betydelig rolle i A baumannii persistens og motstand.
en Annen flate karbohydrater kjent for å påvirke pathogenicity av A baumannii inkluderer lipooligosaccharide (LOS) og exopolysaccharide poly-β-(1-6)-N-acetylglucosamine (PNAG) (Preston et al., 1996; Weber et al., 2016). PNAG danner sammenhengende «lim» av biofilm og utgjør en betydelig andel av biofilm (Choi et al., 2009; Longo et al., 2014)., I motsetning til de fleste Gram-negative bakterier, A. baumannii ikke produsere tradisjonelle lipopolysaccharide, men i stedet en lignende overflate glyco-konjugat, LOS, som består av et lipid kjerne som mangler O-antigenet (Kenyon og Hall, 2013; Kenyon et al., 2014b). Tap av LOS produksjon i A baumannii reduserer stabiliteten i den ytre membran som fører til redusert fitness (Moffatt et al., 2010; Beceiro et al., 2014).
Selv om mange karbohydrater moieties innflytelse pathogenicity, kan det argumenteres for at CPS er en dominerende virulence faktor av A baumannii. Denne anmeldelsen har som mål å konsolidere det som er kjent om A., baumannii kapsel inkludert valgt strukturer, biosyntese og gene organisasjon, rolle CPS i virulence, og potensialet for CPS som et mål for fremtidig vaksine og narkotika utvikling.
Genetiske Organisering av K Loci
Som hele genomet til mer A baumannii isolater bli tilgjengelig, sant mangfold av kapsel strukturer til stede i denne bakterien blir tydelig. Til dags dato, med over 100 unike kapsel loci (KL) har blitt identifisert i A baumannii (Figur 2A) (Shashkov et al., 2017). Disse regionene vanligvis strekker seg fra 20 til 35 kb i størrelse., Analyse av genene regi CPS syntese i ti komplett A. baumannii genomer opprinnelig resulterte i betegnelsen av ni kapsel typer, KL1–KL9, som ble grunnlaget for en universell å skrive ordningen for disse loci (Kenyon og Hall, 2013). Denne ordningen er senere utvidet til å romme identifisering av nye K loci. Den kromosomale beliggenhet i K locus, mellom fkpA og lldP gener, er svært bevart mellom A baumannii-stammer, og inneholder de gener som er nødvendig for biosyntese og eksport som er spesifikke for hver CPS-type (Figur 2) (Hu et al.,, 2013; Kenyon og Hall, 2013). Et unntak fra denne regelen er A baumannii stammer med KL19 og KL39 regioner, der genet koding av Wzy polymerase, wzy, er funnet på en liten genetisk øya andre steder på kromosom (Kenyon et al., 2016a). I tillegg, de genene som er nødvendig for noen av de vanligste sukker sett i CPS er funnet andre steder., Alle K loci viser en tilsvarende genetisk konfigurasjon, en svært variabel klynge av syntese og transferase gener som kreves for biosyntese av unike KL-type komplekse sukkerarter, flankert på den ene siden av den svært bevart CPS eksport gener, og på den andre siden av et sett av genene som koder bevart på enkle sukkerarter og prekursorer (Figur 2A)., Den wzx og wzy gener som er nødvendig for å gjenta-enhet behandling er svært varierende mellom K loci (Figur 2A, lys blå), noe som indikerer spesifisitet for bestemte K enhet strukturer og, generelt, er rekkefølgen av gtr påvirkningsfaktorer, koding bestemt glycosyltransferases innen KL regioner, omvendt samsvarer med bestillingen av handlingen.
variabel-regionen i enkelte KL genet klynger, for eksempel KL37 og KL14, mangel gener for komplekse sukker syntese, som de bare inneholder enkle sukkerarter i sin K enheter (Arbatsky et al., 2015; Kenyon et al.,, 2015). Også legger til sitt mangfold, KL flere regioner inneholder overflødige gener som ikke er nødvendig for syntesen av den siste K-enhet. For eksempel KL8 og KL9 inneholder to itr gener (Kenyon og Hall, 2013) og KL37 har pgt1 phosphoglyceroltransferase, men ingen tilsvarende phosphoglycerol rester i bestemt struktur (Arbatsky et al., 2015). Videre, i KL93, to innsetting rekkefølge elementer (ISAba26 og ISAba22) avbryte pgt1 determinant (Figur 2) (Kasimova et al., 2017)., Gener som er nødvendige for spesifikke sukker biosyntese vil ikke bli diskutert som disse kildene har vært dekket tidligere, og er utenfor omfanget av denne gjennomgangen (Hu et al., 2013; Kenyon og Hall, 2013). I tillegg, andre gener ligger innen KL kode produkter spådd til å bli involvert i acetylation eller acylation endring av spesifikke glycans (Figur 2A, rosa). Selv om undersøkelse av K loci kan avsløre mye om K enhet strukturer, kjemisk analyse og biokjemiske tester er nødvendig for å fastslå nøyaktige strukturer og identifisere konkrete forbindelser mellom gjenta sukker.,
CPS Strukturer
Den tidligste studier på CPS serotyping av A baumannii ble drevet av behovet for å utvikle en metode for å skjelne A baumannii-isolater fra andre Acinetobacter arter, som fenotypiske analyse var beheftet med en tvetydighet og feilidentifisering (Traub, 1989). Som beskrevet ovenfor, det er fenomenal mangfold sees i A baumannii CPS biosyntese genet klynger, som oversettes til mangfoldet sett i K enhet struktur (Hu et al., 2013; Kenyon og Hall, 2013). Kollektivt, over 40 ulike A., baumannii K enhet strukturer har vært belyst så langt ved hjelp av NMR spektroskopi og kjemisk analyse. K enhet forskjellige strukturer i sukker sammensetning. De kan inneholde derivater av felles UDP-linket sukker som glukose, galaktose og glucuronic syre eller sjeldne og atypisk sukker slik som ikke-2-ulosonic syrer. Strukturer varierer i lengde og kan bestå av bare to rester, som vi har sett for K53 type CPS (Shashkov et al., 2018), eller opp til fem eller seks monosakkarider, for eksempel at sett i K37 (Figur 2B) (Arbatsky et al., 2015)., Strukturer er også forskjellige i de sammenhengene både innenfor og mellom K enheter som resulterer i produksjon av K enheter som er lineær eller involvere sidegreiner, som vi har sett i K1 og K93, henholdsvis (Figur 2B) (Kenyon et al., 2016a; Kasimova et al., 2017). Forskjeller i plassering av spesifikke glycosidic obligasjoner og O-acetylation mønstre av ulike oligosakkarider innenfor en struktur også bidra til K-enhet til mangfold.,
Variasjon mellom K-enhet strukturer kan være subtile, for eksempel, K12 og K13 skiller seg bare ved kobling av to glycans, som krever bruk av en alternativ Wzy polymerase; følgelig, K loci av begge stammer er identisk bortsett fra for wzy genet (Figur 2). Alternativt variasjonen kan være slående, for eksempel inkorporering av sjeldne sukker inkludert pseudaminic, legionaminic, eller acinetaminic syre derivater som vi har sett i K2/6, K49, og K12/13 strukturer, henholdsvis (Figur 2) (Kenyon et al., 2014a, 2015; Vinogradov et al., 2014; Kasimova et al., 2018)., Interessant, acinetaminic syre derivater har bare blitt identifisert i A baumannii og er funnet noe annet sted i naturen (Kenyon et al., 2017). I tillegg er det noen K enheter innlemme unike derivater av spesifikke glycans, for eksempel pseudaminic syre av K93 er acetylated med et (R)-3-hydroxybutanoyl gruppe (Kasimova et al., 2017), mens i K2 K6 den pseudaminic syre er ikke-acetylated (Figur 2)., Videre er strukturen i K4 er unik som den inneholder bare aminosugars, D-QuipNAc, og en terminal N-acetyl-D-galactosamine (D-GalpNAcA) gren som er dekket med en pyruvyl gruppe, en sjelden motivet og den første til å bli beskrevet i Acinetobacter (Figur 2A, svart) (Kenyon et al., 2016b). Som nummer av K-enhet strukturer belyst øker, så gjør selvtillit til å utlede K enhet struktur fra analyse av biosyntese klynger plassert i A baumannii KL., Imidlertid, selv om informativ, en forståelse av den rolle CPS spiller i patogenesen er viktig å bruke denne kunnskapen til å forbedre resultatene av A baumannii infeksjoner.
Rolle i Virulence, Antimikrobiell Resistens, og Utholdenhet
Det er hevet over tvil at tilstedeværelsen av CPS er viktig for A baumannii pathogenicity. Ikke bare er det nødvendig for unndragelse av vert immun forsvar (Russo et al., 2010; Geisinger og Isberg, 2015), men det er viktig for resistens mot antimikrobielle forbindelser og overlevelse i ugunstig miljøer (Lukas et al., 2010; Russo et al.,, 2010; Geisinger og Isberg, 2015). CPS formidler immun skatteunndragelser i mange A. baumannii stammer ved å begrense interaksjoner mellom immunogenic overflatestrukturer av bakterier og vert forsvar (Preston et al., 1996; Wu et al., 2009; Russo et al., 2010; Umland et al., 2012; Lees-Miller et al., 2013; Geisinger og Isberg, 2015; Wang-Lin et al., 2017). Avskaffelsen av kapselen i flere forskjellige A. baumannii stammer har vist redusert overlevelse i humant serum og ascites væske, og demping i rotte og murin infeksjon modeller (Russo et al., 2010; Umland et al., 2012; Lees-Miller et al.,, 2013; Sanchez-Larrayoz et al., 2017). Videre, opp-regulering av kapsel produksjon i de vanlig benyttet A. baumannii stamme ATCC 17978 (K3 CPS-type) økt serum motstand og virulence i en mus infeksjon modell (Geisinger og Isberg, 2015). Videre, roman antimikrobielle behandlinger kan være utviklet for spesifikke CPS-typer, for eksempel de som inneholder pseudaminic syre, som sin tilstedeværelse har blitt korrelert med bedre virulence (Hitchen et al., 2010; Kao et al., 2016).
i Tillegg til beskyttelse mot-vert forsvar, i A., baumannii CPS produksjon øker motstanden til et utvalg av antimikrobielle forbindelser, inkludert de som brukes for desinfeksjon i kliniske settinger (Geisinger og Isberg, 2015; Tipton et al., 2015; Chen et al., 2017). Videre vekst av A baumannii i sub-hemmende nivåer av antimikrobielle midler påvirkninger CPS-produksjon. For eksempel eksponering for antibiotika chloramphenicol eller erytromycin førte til forbedret kapsel syntese i ATCC 17978 (Geisinger og Isberg, 2015) og meropenem eksponering valgt for mutasjoner som fører til et tap i CPS-produksjon i isolere 37662 (Chen et al., 2017)., Studier utført på et bredere spekter av A baumannii stammer som er nødvendig for å identifisere om beskyttelse mot antimikrobielle midler gis av CPS er spesifikk belastning, kapsel-type bestemt, eller universal.
evne til A baumannii å vedvare i det kliniske miljøet har utvilsomt forbedret kolonisering og infeksjoner hos disponerte pasienter. A baumannii er i stand til å overleve i flere måneder på sykehus overflater som bed rails, møbler og medisinsk utstyr, og gir et reservoar som er ofte kilde til overføring og infeksjon (Wendt et al., 1997; Gayoso et al., 2013)., Den bemerkelsesverdige uttørking toleranse av A baumannii er tenkt å være på grunn av en «bust eller boom» – strategi, hvor en vedvarende subpopulasjoner av celler overleve på bekostning av døde celler; CPS forbedrer uttørking toleranse ved å gi en fysisk barriere tilrettelegging av væskeansamlinger (Roberts, 1996; Webster et al. I 2000; Gayoso et al., 2013; Bravo et al., 2016). En direkte rolle for CPS i uttørking motstand ble nylig demonstrert i A baumannii belastning AB5075 (K25 CPS-type). I denne studien, acapsular variant av AB5075 vises en 2.,5-fold reduksjon i levedyktighet i forhold til foreldrenes belastning (Tipton et al., 2018). Videre, i to nære slektninger av A baumannii, Acinetobacter calcoaceticus og Acinetobacter baylyi, produksjon av exopolysaccharide og/eller CPS har vist seg å fremme uttørking overlevelse (Roberson og Firestone, 1992; Ofir og Gutnick, 1994). I tillegg til å påvirke motstand mot uttørking, CPS har vært forbundet med andre virulence trekk inkludert motilitet (McQueary et al., 2012; Huang et al., 2014) og produksjon av biofilm (Umland et al., 2012; Lees-Miller et al.,, 2013), og dermed sementere sin rolle som sykdomsfremkallende faktor.
Nylige studier har knyttet til fase-variabel fenotypen av A baumannii AB5075 med endringer i CPS-produksjon, som svært virulente ugjennomsiktig varianter produsere en CPS-lag med to ganger tykkelsen av deres gjennomsiktig kolleger (Chin et al., 2018). Denne overgangen fra gjennomsiktige å ugjennomsiktig også økt dramatisk de potensielle patogene av A baumannii AB5075. Motstand mot felles sykehus desinfeksjonsmidler og et delsett av aminoglycoside antibiotika ble også økt (Tipton et al., 2015; Haken et al.,, 2018) og ugjennomsiktig varianter ble også mer motstandsdyktig mot menneskelig lysozyme, den cathelicidin-relaterte antimikrobielle peptid LL37 og hydrogen peroxide i forhold til gjennomskinnelig kolonier (Chin et al., 2018). Videre, ugjennomsiktig isolater hadde en økt toleranse for uttørkede forhold og ut-konkurrerte gjennomsiktig kolleger i en mus infeksjon modell (Chin et al., 2018). Som flere faktorer som er involvert i fase variasjon, videre studier ble utført for å finne bidrag av CPS produksjon til mer virulente ugjennomsiktig fenotypen., I en følgende publikasjon, forfatterne vist at en acapsular variant ble betydelig mer utsatt for lysozyme og desinfiserende midler i forhold til sine ugjennomsiktig AB5075 wild-type forelder (Tipton et al., 2018). Interessant nok, var det ingen forskjell i motstand mot LL-37 og hydrogen peroxide mellom det ugjennomsiktige wild-type og acapsular stammer, noe som tyder på at andre faktorer enn CPS produksjon føre til denne fenotypen for ugjennomsiktig varianter av A baumannii (Tipton et al., 2018).,
Regulering av CPS Produksjon
Miljømessige indikatorer, for eksempel temperatur, osmotisk trykk og endringer i metabolitt og ion tilgjengelighet kan påvirke bakteriell CPS produksjon (Hagiwara et al., 2003; Lai et al., 2003; Mouslim et al., 2004; Willenborg et al., 2011). Det er overraskende at få regulatoriske mekanismer har blitt identifisert for CPS-produksjon som CPS nivåer er ofte regulert av post-translationally gjennom phosphorylation av CPS-eksport maskiner (Whitfield og Paiment, 2003; Chiang et al., 2017). I A., baumannii, bare to regulatorer av kapsel produksjon har så langt blitt identifisert; BfmRS og OmpR-EnvZ, både to-komponent signal transduksjon systemer som spille flere lover roller som er involvert i konvolutt biogenese (Geisinger og Isberg, 2015; Tipton og Heller 2017; Geisinger et al., 2018). Når det utsettes for antibiotika press, A. baumannii ATCC 17978 cps uttrykk ble økt i en BfmRS-avhengig måte (Geisinger og Isberg, 2015). Fase variasjon, og dermed potensielt CPS-produksjon, er sterkt regulert av OmpR-EnvZ system i A., baumannii AB5075, som mutasjoner i enten OmpR eller EnvZ resulterte i en betydelig økning i ugjennomsiktige til gjennomskinnelig svitsjefrekvens (Tipton og Heller 2017). Selv om overgangen fra gjennomsiktige å ugjennomsiktig resulterer i en to-fold økning i kapsel tykkelse, transcriptomic analyser har ikke funnet noen forskjeller i uttrykk nivåer av KL gener mellom de to fasene.
CPS som et Mål for Utvikling av Vaksiner og behandling Mot A baumannii
Antibiotika (spesielt cabapenem) motstandsdyktig A., baumannii er klassifisert som Verdens helseorganisasjon Prioritet 1 Kritisk organismen for utviklingen av nye antimikrobielle midler (SOM, 2017). Selv om det er ingen ikke-antibiotikum behandlinger eller vaksiner som er lisensiert for A baumannii i dag, er det en økt interesse i deres utvikling og foreløpige studier ser lovende ut. Overflaten eksponering og forekomst i patogene stammer av A baumannii gjør CPS-et ideelt mål for både antimikrobiell behandling og vaksiner (Russo et al., 2013)., Disse inkluderer utvikling av antistoff-baserte terapier som forebyggende vaksiner, passiv immunisering, og phage terapi (García-Quintanilla et al., 2013).
Flere studier har vist at effekten av passiv immunisering i mus ved hjelp av en CPS-spesifikt antistoff, som er beskyttende mot bakterielle utfordring med 13-55% av kliniske A baumannii isolater (Russo et al., 2013; Yang et al., 2017; Lee et al., 2018)., I tillegg grader med konjugat vaksiner innlemme CPS glycans festet til et protein transportøren lokke fram bedre immun beskyttelse enn renset CPS mot et bredt spekter av A baumannii stammer (Yang et al., 2017).
Interesse i phage terapi for å behandle bakterielle infeksjoner har økt i de siste årene i respons til den nåværende krisen i stigende antimikrobiell resistens. Phage terapi er attraktive som en potensiell behandling avenue for multidrug motstandsdyktig A baumannii infeksjoner., For eksempel, en phage koding en CPS depolymerase ble funnet å forringe CPS på ca 10%, fire av 38, klinisk multidrug motstandsdyktig A baumannii ble testet (Hernandez-Morales et al., 2018). Selv om det vert spekter av denne phage er begrenset, kan det være innarbeidet som en del av en phage cocktail for å maksimere effektiviteten, eller målrett mot bestemte utbrudd (Hernandez-Morales et al., 2018). En phage som selektivt cleaves kobling av A., baumannii CPS på en pseudaminic syre gren kan være verdifulle for phage terapi, eller for å effektivt produsere renset CPS for vaksine og antistoff utvikling (Lee et al., 2018). Phage målretting A baumannii ble nylig vist seg å være stabil når impregnert brenne i sårbehandling produkter under en rekke forhold, inkludert i nærvær av antimikrobielle midler (Merabishvili et al., 2017). Men, som de fleste studier som undersøker A baumannii CPS er vanligvis begrenset til en bestemt A. baumannii belastning, det er ikke kjent om disse funnene oversette til alle A., baumannii isolater, eller hvis de er belastning eller kapsel type bestemt. Forstå hvilke roller kapsel spiller i flere stammer som er avgjørende i å identifisere CPS-typer som representerer det beste mål for nye vaksiner, eller om utviklingen av antimikrobielle midler målretting kapsel biosyntese veien er faktisk enda mulig.
Avsluttende Bemerkninger
Selv om kapsel representerer en viktig virulence egenskap av A baumannii det er begrensede data tilgjengelig på den rolle ulike CPS typer spille i å forårsake sykdom., For å utvikle effektive vaksiner og behandling målretting CPS, må vi først få en helhetlig forståelse mot mekanismene bak sin syntese og uttrykk, sammen med de fordeler som kapsel formidler til verten bakterier. Denne forskningen har behov for å bli tatt opp i sammenheng med den ekstreme varianten av CPS serotypes funnet i A. baumannii, for å sikre at potensielle tiltak fungerer mot stammer produserer ulike CPS-strukturer., Videre studier på CPS er pålagt å gi en plattform for utvikling av forebyggende tiltak og behandlinger mot denne stadig mer vedvarende og dødelig human patogen.
Forfatter Bidrag
JS skrev det første utkastet. MB gitt faglige innspill og kritisk gjennomgang av artikkelen. FA produsert genom linjer og gitt kritisk revisjon av manuskriptet. Alle forfattere som er godkjent i den endelige versjonen.
Midler
Dette arbeidet ble støttet av en Flinders Medical Research Foundation Tilskudd til MB. FA ble støttet av AJ og IM Naylon og Playford Tillit Ph. D., Stipend. JS ble støttet av en AJ og IM Naylon Stipend.
interessekonflikt Uttalelse
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller finansielle forhold som kan oppfattes som en potensiell interessekonflikt.
Traub, W. H. (1989). Acinetobacter baumannii serotyping for avgrensningen av nosokomiale utbrudd av kryss-smitte. J Clin. Microbiol. 27, 2713-2716.
PubMed Abstrakt | Google Scholar
Whitfield, C., og Paiment, A. (2003)., Biosyntese og montering av Gruppe 1 capsular polysakkarider i Escherichia coli og relaterte ekstracellulære polysakkarider i andre bakterier. Carbohydr. Res. 338, 2491-2502. doi: 10.1016/j.carres.2003.08.010
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
SOM (2017). Global Prioritert Liste av Antibiotika-Resistente Bakterier til Guide Forskning, Oppdagelse og Utvikling av Nye Antibiotika. Geneve: Verdens Helseorganisasjon.
Google Scholar
