Introduksjon til karbonyl gruppe
I organisk kjemi, karbonyl-gruppen er en funksjonell gruppe hvor karbon og oksygen-atom er koblet til med en dobbel binding. Forbindelser inneholder karbonyl gruppen er kjent som karbonyl forbindelser. Karbonyl-gruppen refererer til en karbonmonoksid kan også knyttet til en uorganisk atom som en ligand som er kalt metal karbonyl, f.eks. nikkel karbonyl.,
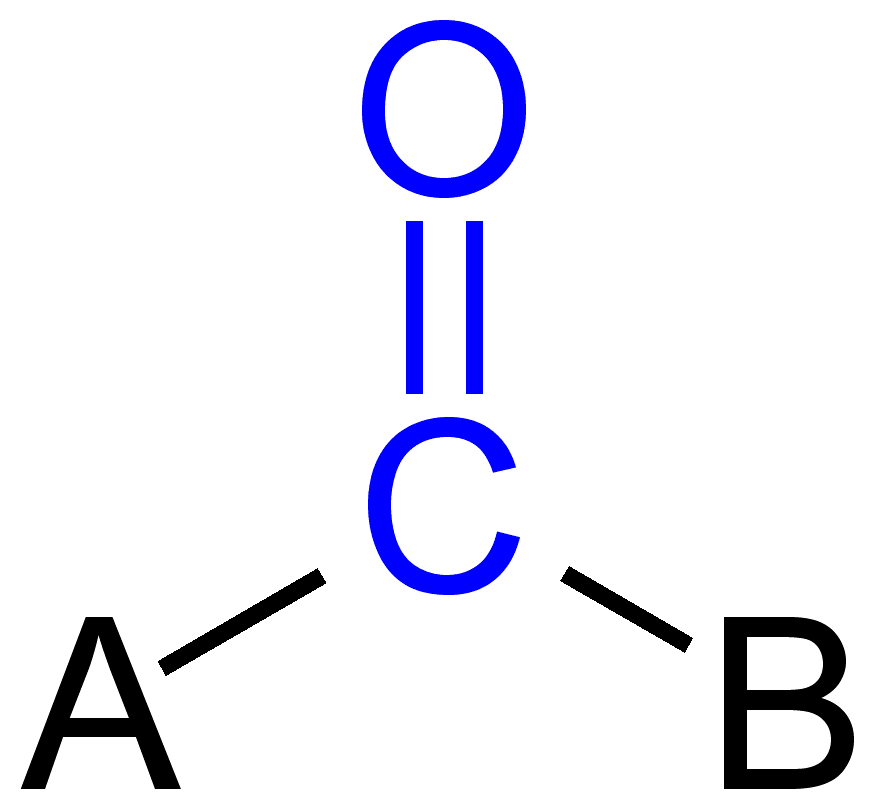
Noen karbonyl grupper
dobbeltbindingen i karbonyl gruppe
karbon og oksygen-atom i karbonyl-gruppen er normalt sp2 hybridiserte og dermed plannar. På grunn av tilstedeværelsen av oksygen som en electronegative atom, dobbeltbindingen i karbonyl gruppen er annerledes enn den doble bindingen i mellom hx og alkener i form av reaktivitet. På grunn av mer electronegativity og tilstedeværelse av to ensomme par av elektroner, oksygen blir delvis negativt ladet mens karbonyl karbon genererer delvis positiv ladning og dermed polaritet er observert.,
Karbonyl resonans struktur
på Grunn av tilstedeværelsen av oksygen som en electronegative atom, karbonyl gruppen viser resonans struktur. Resonans struktur av karbonyl gruppe påvirker reaktiviteten av det sammensatte. Mer electronegative oksygen atom trekker unna elektron fra karbon center gjør karbonyl karbon delvis elektropositiv og oksygen delvis electronegative. Dermed polaritet genererer innenfor karbonyl sammensatte.
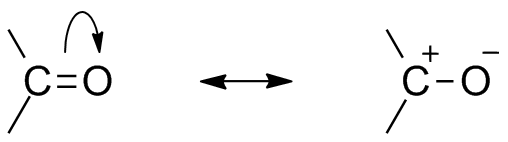
Dette elektropositiv karbonyl karbon eller electrophile kan nå bli angrepet av en nucleophile.,
Reaktivitet
Karbonyl Alkylation
Alkylering av karbonyl gruppe av nucleophilic tillegg reaksjon ved hjelp av Grignard reagens er vist som følger:

Fysiske egenskaper til karbonyl forbindelser
- kokepunkt av aldehyder og ketoner er høyere enn kokepunktet til ethers og alkaner med lignende molekylære massen.
- Igjen kokepunkt av aldehyder og ketoner er lavere enn tilsvarende alkoholer.,
- Mange høyere aldehyder har behagelig lukt og brukes i parfyme eller som et kunstig smakstilsetning, mens den nedre medlem av deres homologe serien har stikkende lukt.
- Høyere ketoner har svak lukt og lavere har behagelig lukt, slik som aceton.
- Små aldehyder og ketoner er løselig i vann, men som kjede lengde øke løseligheten synker.
- van der Waals spredning styrker bli sterkere som molekylene blir lengre og lengre.,
H-binding i karbonyl goup
på Grunn av dannelse av H-binding mellom karbonyl oksygen og hydrogen med vann molekylet, nedre karbonyl forbindelser er løselig i vann. Men som kjeden øker, det kommer på den måten å danne hydrogen bond og løseligheten synker.
Van der Waals dipol-dipol-attraksjon
på Grunn av polaritet i karbonyl gruppe og tilstedeværelsen av spredning styrker det vil bli en attraksjon mellom to nærliggende molekyler. Dette fører til kokepunktet til karbonyl forbindelser gå høyere enn den tilsvarende alkaner., I følgende tabell merke til at kokepunktet for karbonyl forbindelser er høyere enn den tilsvarende alkaner og lavere enn alkohol.,v>Boiling point (o C)
Spectroscopy
Infrared spectroscopy
The absorption of carbonyl group depends on the geometry of the molecule., Vanligvis absorpsjon av infrarød lys viser på wavenumbers ca 1600-1900 cm−1 (5263 nm til 6250 nm).
Nuclear Magnetic Resonance
karbon-NMR av karbonyl karbon viser peak ca mellom 160-220 ppm.
