6.3 Hoe is energie gerelateerd aan de golflengte van straling?
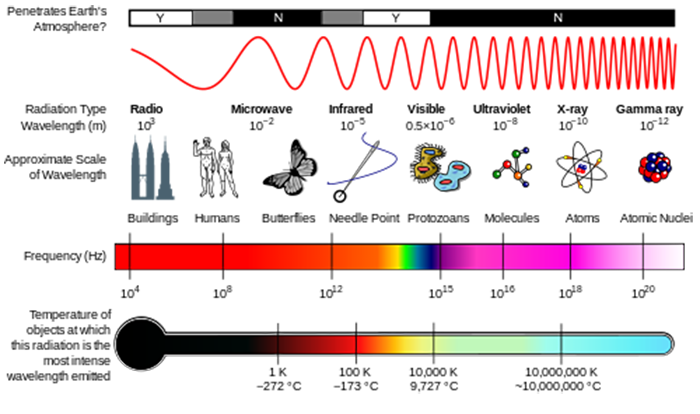
We kunnen straling zien als golven of als individuele deeltjes die fotonen worden genoemd. De energie van een enkel foton wordt gegeven door E = hv, waarbij E de energie is (SI-eenheden van J), h de constante van Planck is (h = 6,626 x 10-34 J s), en ν de frequentie van de straling is (SI–eenheden van S-1 of Hertz, Hz) (zie figuur hieronder)., De frequentie is gerelateerd aan de golflengte Door λ = c / ν, waarbij c, de lichtsnelheid, 2.998 x 108 m s–1 is. Een andere hoeveelheid die u vaak zult zien is wavenumber, σ = 1 / λ, dat vaak wordt gerapporteerd in eenheden van cm-1.
de energie van een enkel foton met de golflengte λ wordt gegeven door:
E = HC λ = 1.,Ffea0dXdd9vqaq=JfrVkFHe9pgea0dXdar=Jb9hs0dXdbPYxe9vr0=vr0=vqpi0dc9GqpWqaaeaabiGaciaacaqabeaadaabauaaaOqaaabbaaaaaaaaIXwyJTgapeGaamyraiaabckacqGH9aqpcaqGGcWaaSaaaeaacaWGObGaam4yaaqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGyoaiaaiIdacaaI2aGaey41aqRaaeiOaiaaigdacaaIWaWdamaaCaaaleqabaWdbiabgkHiTiaaigdacaaI2aaaaOGaaeiOaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeiCaiaabIgacaqGVbGaaeiDaiaab+gacaqGUbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5AA2@
Note that as the wavelength of light gets shorter, the energy of the photon gets greater., De energie van een mol fotonen met de golflengte λ wordt gevonden door de bovenstaande vergelijking te vermenigvuldigen met het getal van Avogadro:
E m = hc N A λ = 1.,GaamyqaaWdaeqaaaGcpeqaaiabeU7aSbaacqGH9aqpcaqGGcWaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiiaiaabQeacaqGGaGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiabeU7aSbaaaaa@5A32@
in de les over atmosferische samenstelling zag je hoe zonne-UV-straling moleculen uit elkaar kon breken om atmosferische chemie in gang te zetten. Deze moleculen absorberen de energie van een foton van straling, en als die fotonenergie groter is dan de sterkte van de chemische binding, kan het molecuul uit elkaar breken.
Controleer uw begrip
overweeg de reactie O3 + UV → O2 + O*. Als de bindingssterkte tussen O2 en O* (d.w.z.,, opgewonden zuurstofatoom) is 386 kJ mol-1, Wat is de langste golflengte die een foton kan hebben en toch deze band kan breken?
antwoord: oplossen voor golflengte in vergelijking
λ = 1,196 × 10 8 J nm mol -1 E M = 1.,ab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaGcpaqaa8qacaWGfbWdamaaBaaaleaapeGaamyBaaWdaeqaaaaak8qacaqGGcGaeyypa0ZaaSaaa8aabaWdbiaaigdacaGGUaGaaGymaiaaiMdacaaI2aGaaeiOaiabgEna0kaabckacaaIXaGaaGima8aadaahaaWcbeqaa8qacaaI4aaaaOGaaeiOaiaabQeacaqGGcGaaeOBaiaab2gacaqGGcGaaeyBaiaab+gacaqGSbWdamaaCaaaleqabaWdbiabgkHiTiaaigdaaaaak8aabaWdbiaaiodacaaI4aGaaGOnaiaabckacqGHxdaTcaqGGcGaaGymaiaaicdapaWaaWbaaSqabeaapeGaaG4maaaakiaabckacaqGkbGaaeiOaiaab2gacaqGVbGaaeiBa8aadaahaaWcbeqaa8qacqGHsislcaaIXaaaaaaakiabg2da9iaaiodacaaIWaGaaGyoaiaabckacaqGUbGaaeyBaaaa@817C@
